



20.1 Introduction
- 상업적 가치가 가장 큰 커피 種은
┌ Coffea arabica L.과
└ Coffea canephora Pierre var. robusta로, 일반적으로 "아라비카"와 "로부스타" 커피로 알려져 있다. - 이 두 種은 官能的 特性과 化學的 組成 모두에서 중요한 차이점을 보인다.
- 아라비카 커피 생두의 脂質 함량은 평균 약 15%인 반면,
로부스타 커피는 약 10%로 훨씬 적다. - 대부분의 脂質(lipids), 소위 커피 오일은
⇒ 생두의 內胚乳(endosperm)에 있으며,
⇒ 소량의 커피 왁스(coffee wax)만이 생두의 바깥층에 있다. - 비교적 큰 不鹼化物 부분(unsaponifiable fraction)에는
⇒ 카우란 계열(kaurene family)의 디테르펜(diterpenes),
⇒ 주로 카페스톨(cafestol), 카웨올(kahweol), 16-O-methylcafestol이 풍부하게 함유되어 있으며,
⇒ 이는 다양한 생리적 효과로 인해 최근 몇 년 동안 점점 더 많은 관심을 받고 있다
(see Coffee: Consumption and Health Implications). - 더욱이, 16-O-methylcafestol은
⇒ 커피 블렌드에 로부스타 원두가 함유되어 있음을 나타내는 신뢰할 수 있는 지표이다. - 不鹼化物 부분의 일부이기도 한 스테롤(sterols) 중에서, 다양한
데스메틸스테롤(desmethylsterol), 메틸스테롤(methylsterol), 그리고 디메틸스테롤(dimethylsterol)이
식별된 바 있다. - 커피 生豆의 脂質 부분(lipid fraction)의 평균 조성 백분율은 Figure 20.1에 제시되어 있다.

20.2 Coffee Oil
20.2.1 Total Oil Content
- 아라비카 커피 생두의 지질 함량(lipid content)은 건조 기준으로 평균 약 15%인 반면,
로부스타 커피는 그보다 훨씬 적은 약 10%이다. - 대부분의 지질, 즉 커피 오일은 ⇒ 그 커피 콩의 胚乳(endosperm)에 위치하며,
소량인 커피 왁스(coffee wax)만이 ⇒ 外皮에 존재한다. - 粗 커피 오일(crude coffee oil)의 수율은
⇒ 그 콩들의 조성(composition) 뿐만 아니라,
⇒ 추출 조건(composition),
용매 선택(choice of solvent), 그리고
특정 입자 크기(particular particle size)에 따라 달라진다. - 수율의 차이가 크기 때문에 “커피 오일”이라는 용어를 더 명확하게 정의할 필요가 있다.
- 볶은 커피(焙煎豆)의 오일 함량은 그린 커피(生豆)보다 높은데,
이는 로스팅 과정에서 전체 건조 물질 함량 손실이 발생하기 때문이며,
이 손실은 로스팅 정도에 따라 달라진다. - 그러나 실제 지질 손실량은 적다 [1].
- 그린 커피 오일(커피 생두의 오일)은 디테르펜 함량이 높아 사람이 섭취하기에 적합하지 않다.
- 그럼에도 불구하고, 지방산(fatty acids)과 디테르펜(diterpenes)이 제공하는
피부 진정 효과(emollient properties)와 그리고
인체 피부에 유해한 것으로 입증된 자외선의 차단 효과 덕분에
그린 커피 오일은 수년간 화장품 산업에서 널리 사용되어 왔다 [2]. - 결함이 있는 그린빈에서 추출한 커피 오일은
바이오디젤(biodiesel) 생산의 원료로 활용될 가능성이 제기되기도 했다 [3]. - 커피 오일의 화학적 조성을 심층적으로 연구하기 위해서는,
⇒ 酸 처리 없는 직접 용매 추출(direct solvent extraction without acid treatment)이 필요하다. - Picard 외 연구진에 따르면 [4],
⇒ 몇몇 저자들이
디에틸 에테르(diethyl ether),
다양한 끓는점 범위를 가진 석유 에테르(petroleum ether),
n-헥산(hexane), 그리고
디에틸 에테르와 n-헥산의 혼합물을 사용했다.
⇒ 연구 결과는 균질하지 않았는데,
⇒ 선택한 용매에 따라
카페인과 같이 극성이 더 강하고 지질 함량이 더 낮은 물질도 부분적으로 추출되었기 때문이다. - Folstar et al.[5]은
⇒ 용매 추출에서 얻을 수 있는 수율은
커피가 최종적으로 분쇄되는 입자 크기에 따라 달라진다는 것을 보여주었다. - Speer [6]는
⇒ 입자 크기가 0.25~0.63 mm인 분쇄 커피를 추출하고,
⇒ 위험한 디에틸 에테르(diethyl ether)를 피해서 tertiary butyl methyl ether를 추출 용매로 사용했다.
⇒ 이 방법은 DIN 방법 10779 (ref. 7)로 채택되었으며, 다음과 같이 설명되어 있다:
⇒ 볶은 커피 원두를 일반 커피 분쇄기에서 굵게 분쇄하고 0.63mm 체에 통과시킨다.
체로 걸러진 물질 5g을 막자사발(mortar)에서 황산나트륨(sodium sulfate)과 함께 분말화한 후,
Soxhlet (4시간)에서 tertiary butyl methyl ether로 추출하고,
시간당 6~7회 siphoning 해준다.
용매를 증발시키고 잔류물을 일정한 무게(105 ℃)로 건조한다.
추출 시간을 길게(6, 8 또는 10시간) 설정해도 지질 함량은 증가하지 않는다.
생두의 경우, 분쇄기를 사용하여 드라이아이스와 함께 분쇄한다.
⇒ 결과적으로, 遊離 디테르펜(free diterpenes)과 같은 극성 물질의 수율이 높아졌다. - de Azevedo et al. [8]이
⇒ 제안한 초임계 이산화탄소(supercritical carbon dioxide)를 이용한 추출법은
디테르펜 분석에 매우 편리한 것으로 보인다.
20.3 Fatty Acids
20.3.1 Total Fatty Acids and Fatty Acids in Triacylglycerides
- 대부분의 지방산(fatty acids)은 ⇒ 결합된 상태로 존재한다.
- 약 75%는 트리아실글리세리드(triacylglycerides) (TAG)에서 글리세롤(glycerol)과 에스테르化되어 있고,
약 20%는 디테르펜(diterpenes)과 에스테르화되어 있으며,
소량은 스테롤 에스테르(sterol esters)와
소위 카르복실산-5-하이드록시트립타미드(carboxylic acid-5hydroxytryptamides, C-5HT)에 존재한다. - Triacylglycerides는
⇒ 팔미트산(palmitic acid, P), 리놀레산(linoleic acid, L),
스테아르산(stearic acid, S), 올레산(oleic acid, O)으로 구성된 분자종이며,
⇒ PLL, PLP, PLO + SLL, LLL, OLL, OLO, POP, SOS가 현재까지 확인된 전형적인 TAGs 종들이다. - 또한, TAG 구성 및 농도 측면에서
아라비카와 로부스타 종 간의 중요한 차이점을 강조하는 것이 중요하다. - 따라서 아라비카 샘플은 LLL 농도가 더 높으며, 아라비카는 6.1%, 로부스타는 3.7%의 특징적인 비율을 보인다.
- 그러나 아라비카는 OLO 함량이 1.1%로 로부스타의 2.3%보다 낮다는 특징이 있다.
- 이는 PLO + SLL에도 해당한다.
실제로 아라비카는 PLO + SLL 함량이 13.8%로 로부스타의 16.4%보다 낮다 [9]. - Folstar et al.[5], Picard et al.[4], Speer et al.[10]은
⇒ 트리아실글리세리드(triacylglycerides),
스테롤 에스테르(sterol esters),
디테르펜 에스테르(diterpene esters)의 지방산들을 분석했다. - Folstar et al.[5]은 다양한 지질 계열을 분리하기 위해 Florisil 컬럼을 사용했다.
- Speer et al. [10]은
⇒ 겔 투과 크로마토그래피(gel permeation chromatography)를 통해 triacylglycerides를 분리하고,
⇒ 메틸화칼륨(potassium methylate)으로 에스테르 교환 반응을 수행한 후 (transesterified),
⇒ RTX 2330으로 코팅된 60μm 용융 실리카 모세관 컬럼을 사용하여
⇒ 메틸화된 지방산(methylated fatty acids)을 크로마토그래피 분석했다.
⇒ 총 지방산(total fatty acids)과
트리아실글리세리드 내 지방산(fatty acids in the triacylglycerides) 간에는 유의미한 차이가 없었다 [11].
⇒ 아라비카와 로부스타 커피의 경우,
로스팅 과정에서 트랜스 지방산(trans fatty acid) 레벨,
특히 C18:2ct와 C18:2tc 함량이 증가한다는 점에 유의해야 한다 [12].
20.3.2 Free Fatty Acids
- 커피에 존재하는 遊離脂肪酸(free fatty acids, FFA)은 여러 저자들에 의해 기술되었다 [13–16].
- 그러나 이러한 모든 데이터는 지방 분석에 사용되는 일반적이지만 간접적인 측정 방법인 酸價(acid value)로 표현되었다.
- 커피의 경우, 이 滴定法(titration method)은 遊離脂肪酸 자체 뿐만 아니라 다른 酸 化合物도 포함하기 때문에, 매우 근사치에 불과하다.
- 따라서 Speer et al.[10]은 遊離脂肪酸을 직접 측정하는 방법을 개발했다.
⇒ 위에서 언급한 BioBeads S-X3를 이용한 겔 크로마토그래피 시스템을 사용하면,
⇒ 3차 부틸 메틸 에테르(tertiary butyl methyl ether)로 추출한 커피 지질을
세 가지 개별 분획으로 나눌 수 있다:
┌ 트리아실글리세리드를 포함하는 분획,
├ 디테르펜 지방산 에스테르(diterpene fatty acid esters)를 포함하는 분획, 그리고
└ 遊離지방산을 포함하는 분획이다.
⇒ 후자는 BF3/메탄올(BF3/methanol)로 전환시키고,
모세관 가스 크로마토그래피를 통해 메틸 에스테르(methyl esters)로 측정하였다. - 9가지 遊離 脂肪酸들이 검출되었다; 로부스타와 아라비카 커피에 각각 매우 균일하게 분포되어 있다.
- 두 커피 種 모두에서
⇒ 주요 지방산은 C18:2와 C16이었다.
⇒ C18, C18:1, C20, C22는 다량 검출되었지만,
⇒ C14, C18:3, C24는 미량만 검출되었다. - 아라비카와 로부스타의 차이는
⇒ 크로마토그램(Figure 20.2)에서
스테아르산(stearic acid)과 올레산(oleic acid) 함량을 비교할 때만 드러난다.
⇒ 로부스타에서는 스테아르산의 비율이 올레산의 비율보다 현저히 낮지만,
아라비카 커피에서는 이 두 酸의 비율이 거의 같다.
⇒ Stearic acid/oleic acid 비율은 커피 블렌드에서 로부스타에 대한 첫번째 지표가 될 수 있다. - Martin et al. [17]은
⇒ 가스 크로마토그래피 분석에서 얻은 데이터를 처리하는 기본 도구로
Principal Components Analysis (PCA)과
Linear Discriminant Analysis (LDA)을 사용했다.
⇒ PCA는 올레산, 리놀레산, 미리스틴산(myristic acid)을 고려하여
아라비카와 로부스타 종을 분리할 수 있도록 한다. - Rui Alves et a. [18]은
⇒ 생두와 로스팅된 커피 품종의 진위 여부를 판별하기 위해 지방산 프로필을 분석했다.

20.4 Diterpenes in the Lipid Fraction
of Robusta and Arabica Coffees
- 커피의 주요 디테르펜(diterpenes)은
⇒ 카우란 골격(kauran skeleton)을 기반으로 하는
오환식 디테르펜 알코올(pentacyclic diterpene alcohols)이다. - Bengis & Anderson [19], Chakravorty et al. [20,21], Wettstein et al. [22],
Haworth & Johnstone [23], 그리고 Finnegan & Djerassi [24] 등은
⇒ 커피 디테르펜 중 두 가지인
┌ 카웨올(kahweol)과
└ 카페스톨(kahweol)의 구조를 규명했다.
⇒ 두 물질 모두 산, 열, 빛에 민감하며, 특히 카웨올은 정제된 형태에서 불안정하다. - 1989년, 로부스타 커피콩에서 16-O-methylcafestol (16-OMC)이 분리되었고,
⇒ 그 구조는 NMR, GC/MS, 결정들에 대한 X-ray 분석 및 합성을 통해 밝혀졌다.[25,26] - 로부스타 커피콩에서
16-O-methylkahweol (16-OMK)과 함께
또 다른 O-methyl diterpene이 확인되었다 [11].
⇒ 이 디테르펜의 구조식은 Figure 20.3에 정리되어 있다.
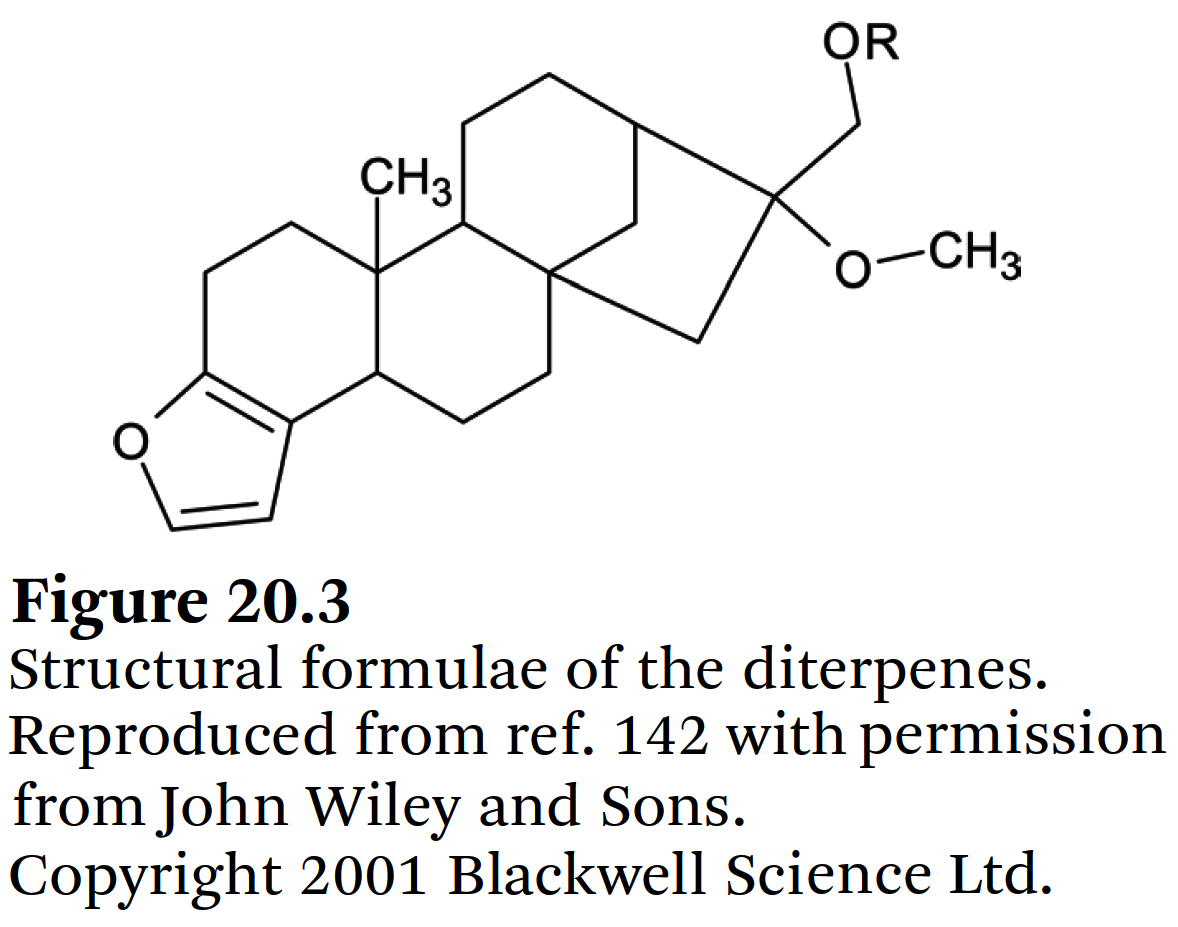
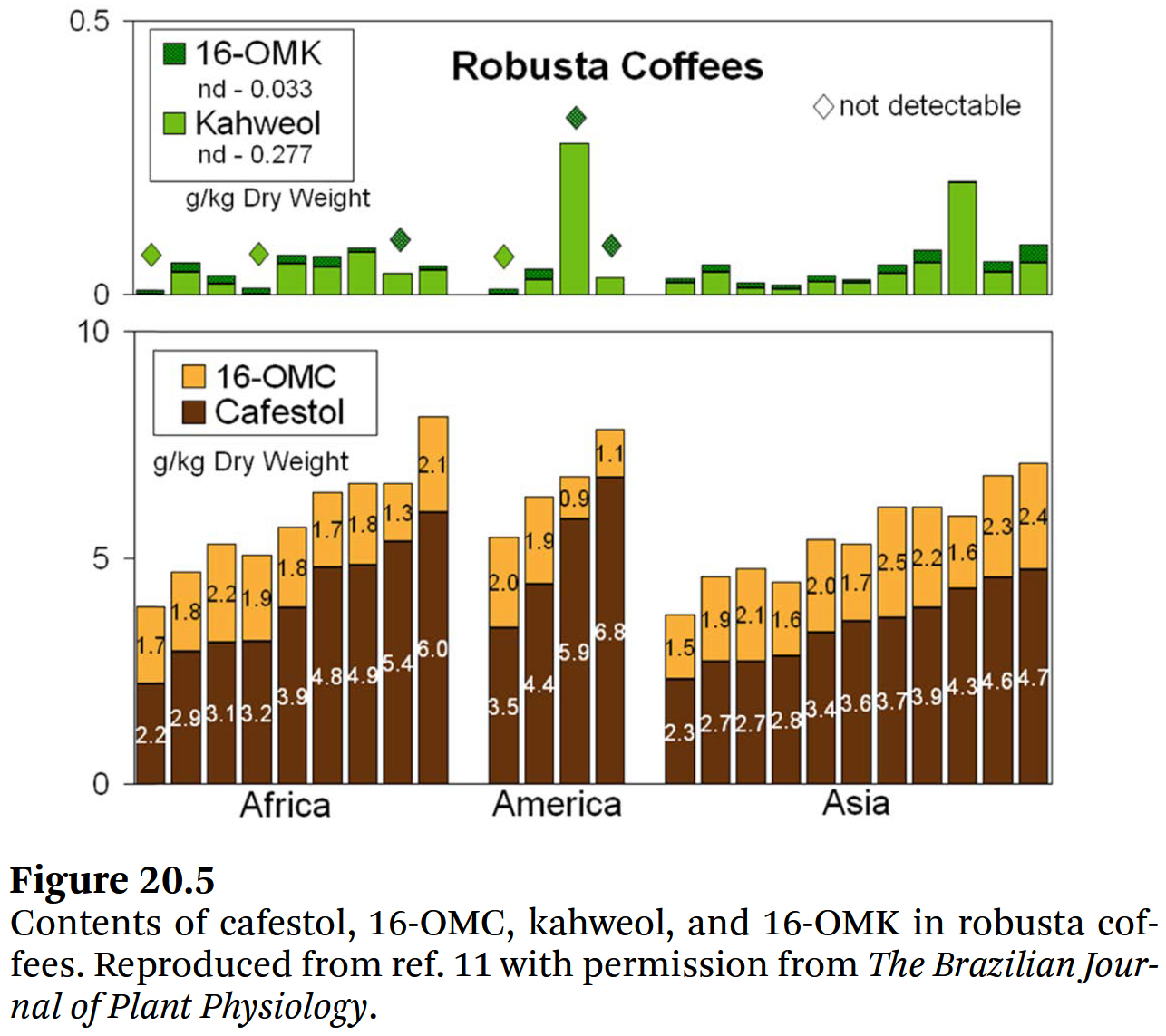
- 아라비카 커피에는 cafestol과 kahweol이 함유되어 있으며,
로부스타 커피에는 cafestol과 소량의 kahweol(건조 중량 0.1g kg−1 미만), 그리고
로부스타 커피 콩들에서만 측정되는 16-OMC가 함유되어 있다 [26, 27]
(Figures 20.4 및 20.5). - 아라비카 커피 콩에 16-OMC가 존재하지 않는다는 사실은
Frega et al. [28], White et al. [39], Trouche et al. [30],
Kamm et al. [31], D'Amelio et al. [32], 그리고 최근에는 Monakhova et al. [33]에 의해 확인되었다. - 로스팅 과정에서도 안정성을 유지하는 16-OMC는
⇒ 아라비카 커피 블렌드에서 로부스타를 신뢰성 있게 검출하는 데 이상적인 품질 특성이 되었다.[27]

- 여기서 16-OMC는
⇒ 아라비카 커피 콩에서는 검출되지 않았지만,
⇒ 아라비카 커피 나무의 다른 부분, 예를 들어 잎에서 발견되었다는 점을 언급해야 한다 [34]. - 다양한 분광법들을 사용하여 명확하게 식별된 16-OMK는
다양한 로부스타 커피들의 생두와 로스팅된 원두 모두에서 측정되었다 [11].
⇒ 이러한 결과는 이 성분이 코페아 스테노필라(Coffea stenophylla)에만 존재한다고 기술한
de Roos et al. [35]의 주장과 대조된다. - 언급된 그 디테르펜은 커피 콩들에만 존재하는 고유한 화학 물질이다.
- 디테르펜인 카페스톨, 카웨올, 16-OMC, 16-OMK는 주로 다양한 지방산들과 에스테르화되어 있으며,
遊離 형태로 존재하는 것은 2~3%에 불과하다. - 총 디테르펜 량을 분석하기 위해, 분쇄 커피 콩 또는 추출된 커피 오일을 비누화(saponified)했다.
⇒ 그런 다음, 비누화 되지 않는 물질에서 디테르펜을 GC를 사용하여[26,28] 또는
아세토니트릴/물을 용리액으로 사용하는 RP-HPLC를 사용하여
직접 측정했다 (Nackunstz and Maier, 1987,36 Speer, 1989,6 그림 20.6 참조). - 파생체화(derivatization) 없이 GC 또는 GC/MS를 사용하여
遊離 디테르펜(free diterpenes)을 분석할 경우,
⇒ 아티팩트(artefact)를 방지하기 위해
분할/비분할 주입기(split/less injector) 대신
콜드온컬럼 주입기(cold-on-column injector)를 사용해야 한다 [37]. - 독일에서는 로스팅된 커피의 16-OMC 측정을 위한 검증된 방법이
⇒ 독일표준화연구소(German Institute for Standardization)의 DIN 방법 10779 (참고문헌 7)로 발표되었다.
⇒ Speer [6]의 HPLC 방법을 기반으로 하는 이 DIN 방법은
아라비카 커피와 블렌딩된 커피에서 2% 미만의 로부스타 성분을 검출할 수 있다.

- 그 검증된 DIN 방법 10779 (ref. 7)는 좋은 결과를 보여준다.
- 그러나 이 방법은 시간이 많이 소요되고,
특히 첫 번째 단계인 커피 오일 추출로 인해 많은 양의 유기 용매가 필요하다. - 따라서 커피 시료는 사전 지질 추출 없이 바로 비누화되었다.
⇒ 이 방법을 적용하면 인스턴트 커피에서도 16-OMC를 정량할 수 있다 [38]. - 추출 속도를 높이기 위해
⇒ liquid–liquid extraction 대신
⇒ kieselguhr(硅藻土)(absorbent diatom earth 흡착성 硅藻土)를 사용하는
SPE(Suppression Peroxide)를 사용한다 (Figure 20.7).

- DIN 방법[7]과 유사하게, 최대 2%의 함량을 측정할 수 있다.
⇒ 소량의 遊離 16-OMC가 포함되지 않는다는 점을 고려하면, 얻어진 결과는 유의미하다.
⇒ 분석에 2~3일이 걸리는 DIN 방법과 비교했을 때, 약 3~4시간만 소요된다.
⇒ 시간 절약 외에도 용매 소비를 상당히 줄일 수 있다. - 아라비카에서 로부스타 부분에 대한 분석에는 다른 여러 방법이 적용되었다 :
⇒ Kamm et al. [31]이 개발한 온라인 LC-GC 방법이다. - 또한 NMR을 사용하면 생두와 로스팅된 커피를 별도의 정제 과정 없이 직접 분석할 수 있다 [32,33].
⇒ 최대 2% 및 3% 그리고 그 이상의 함량이 정량화될 수 있을 것이다;
결과적으로, 인스턴트 커피에서 16-OMC의 존재를 입증하는 것은 불가능하다. - 몇몇 연구들에서 근적외선 분광법(Near-Infrared Spectroscopy, NIR)을 다루었으며,
아라비카와 로부스타라는 두 커피 종의 차이점이 명확해졌다. - 그러나 커피는 카페인, 클로로겐산과 그 파생체들, 다당류, 단백질, 지질 등 다양한 유기 분자가
소량 또는 다량으로 결합된 형태이다.
⇒ 따라서 모든 분자가 NIR 스펙트럼에 미치는 영향을 분석하는 것은 어렵다. - 그러므로 NIR은 커피 산업에 귀중한 도구가 될 수 있지만,
여기서 정의된 물질들을 분석해야 하기 때문에 그 결과는 법정에서 유효하지 않을 것이다 [41–43]. - 마찬가지로, Keidel et al. [44]과 Wermelinger et al. [45]은
⇒ 아라비카 생두와 로부스타 커피 생두를 구별하기 위해
라만 분광법(Raman spectroscopy)을 수행했다. - Wermelinger et al.은
⇒ Soxhlet 시스템을 사용하여 로부스타와 아라비카 커피 추출물(extracts)을 얻었다.
⇒ 그런 다음 용질을 추가 정제 없이 라만 분광법으로 분석했다.
⇒ 2개의 라만 피크들, 카웨올에 특징적인 피크와 지방산에 특징적인 피크 간의 강도 비율을 통해
주어진 혼합물의 로부스타 함량을 측정할 수 있다.
⇒ 제시된 연구에서 모델 시스템의 검출 한계는 4.9%에서 7.5% 사이였다.
20.4.1 Free Diterpenes
- 디테르펜(diterpenes)인 카페스톨(cafestol), 카웨올(kahweol), 16-OMC는
遊離 형태로는 커피 오일에서 미량 성분으로만 존재한다. - 이들을 정량화하려면
⇒ 지질 부분의 주요 화합물,
즉 분석을 방해하는 디테르펜 에스테르(diterpenes esters)와
트리아실글리세리드(triacylglycerides)로부터 분리하는 효과적인 방법이 필요하다.
⇒ 겔 투과 크로마토그래피를 사용하면
遊離 디테르펜 분획을 후속 RP-HPLC로 분석할 수 있다 [46,47].
⇒ 각각의 총 함량에서 遊離 디테르펜(free diterpenes)의 비율은 일반적으로 3.5% 미만이다.
⇒ 일부 로부스타 커피에서만, 0.1 g/kg −1 (건조 중량) 미만인 소량의 total kahweol 때문에,
미량의 카웨올 흔적이 예상대로 검출되었다. - 遊離 디테르펜(free diterpenes)과 遊離 지방산(free fatty acids)의 양은 생두의 보관 조건에 영향을 받았다.
⇒ 저온 및 건조 보관은 카페스톨 함량을 약간만 증가시켰지만,
⇒ 5℃와 40℃에서 보관한 잘 건조되지 않은 커피들에서는
total cafestol 함량의 최대 16%까지 더 높은 함량으로 측정되었다.
⇒ 그 이유는 리파아제(lipase) 효소의 활성 때문이었다.
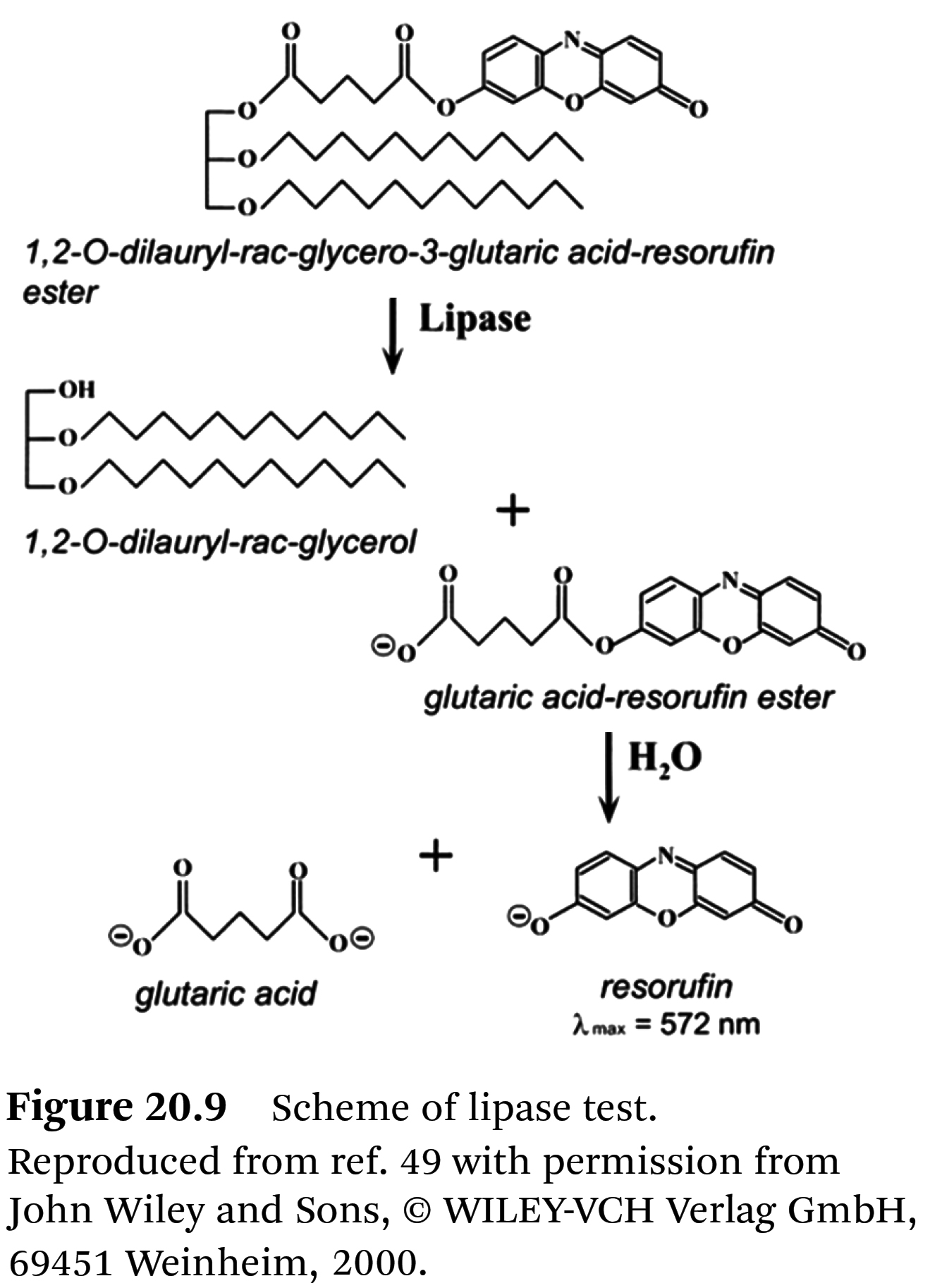
⇒ 저온과 낮은 수분 함량은 이 효소를 가역적으로 억제했다 [48]. - 이 효소를 검출하기 위해 저자들이
수정한 리파아제 테스트 (Roche Company for clinical diagnostics)를 사용하여
다양한 ages의 커피를 분석했다 [48].
⇒ 이 검사는 특정 기질인 1,2-O-dilauryl-rac-glycero-3-glutaric acid-resorufin ester 가수분해를
기반으로 했다 (Figure 20.9).
⇒ 디아실글리세리드(diacylglycerides)에서 분리된 후,
나머지 분자는 알칼리성 매질에서 글루타르산(glutaric acid)과 레조루핀(resorufin)으로
자발적으로 해리되었다.
⇒ 레조루핀(resorufin)은 λ = 572 nm에서 광도 측정으로 검출할 수 있다.
⇒ 붉은색 염료의 강도는 리파아제의 활성에 비례한다.
- 먼저, 분쇄 커피를 아스코르브산나트륨(sodium ascorbate) 용액으로 추출했다.
⇒ 효소 활성을 측정하기 위해 이 용액의 일부를 알칼리성 완충액과 발색 시약과 혼합했다.
⇒ 소멸률을 측정한 후, 혼합물을 37℃에서 6시간 동안 배양하고 소멸률을 다시 측정했다.
⇒ 커피 시료의 소멸률이 空시험 결과의 소멸률보다 높을 때 리파아제 활성이 확인되었다.
⇒ 이를 통해 신선한 커피 뿐만 아니라 최대 10년까지 보관된 커피의 리파아제 활성도 측정이 가능했다. - 로스팅 과정 전에 커피 콩들을 찌면(steaming)
⇒ 선택한 스티밍 파라미터들에 따라 개별 遊離 디테르펜 함량이 감소한다 [50,51].
⇒ 강력한 찌는 과정(2bar에서 120분)을 통해 遊離 카웨올이 완전히 분해되었다. - 찐 커피(steamed)와 찌지 않은 커피(unsteamed coffee)가 모두 이용 가능하다면,
⇒ 遊離 카웨올 함량은 찐 커피를 평가하는데 유용한 도구가 될 것이다 [52].
20.4.2 Diterpene Fatty Acid Esters
- 1987년까지는 서로 다른 지방산들을 함유하는 카페스톨(cafestol) 및 카웨올(kahweol)의 에스테르(esters)가
몇 가지만 보고되었다 [5,53–55]. - Speer 연구팀은 16-OMC의 에스테르를 추가로 여러 개 발견했다 [58,59].
⇒ Gel chromatography를 이용하여 디테르펜 에스테르를 스테롤 에스테르와 함께 분리하였고,
스테롤 에스테르는 실리카 카트리지에서 고체상 추출법을 사용하여 제거했다.
⇒ 로부스타의 경우, 카페스톨과 카웨올 에스테르를 포함하는 분획 하나와
16-OMC 에스테르를 포함하는 분획 하나를 얻었으며,
아라비카의 경우 단 하나의 분획만 얻었다.
⇒ 이후 acetonitrile/isopropanol을 용리액으로 사용하여 RP-HPLC로 분석하면
개별 에스테르를 정량할 수 있다. - Figure 20.10은
⇒ 로부스타 커피 샘플의 카페스톨 에스테르에 대한 반분취 크로마토그램을 보여주고, - Figure 20.11은
⇒ 동일 샘플의 16-OMC 에스테르에 대한 크로마토그램을 보여준다. - Figure 20.12, Table 20.1에
⇒ 아라비카 커피의 카페스톨과 카웨올 에스테르가 제시되어 있다.
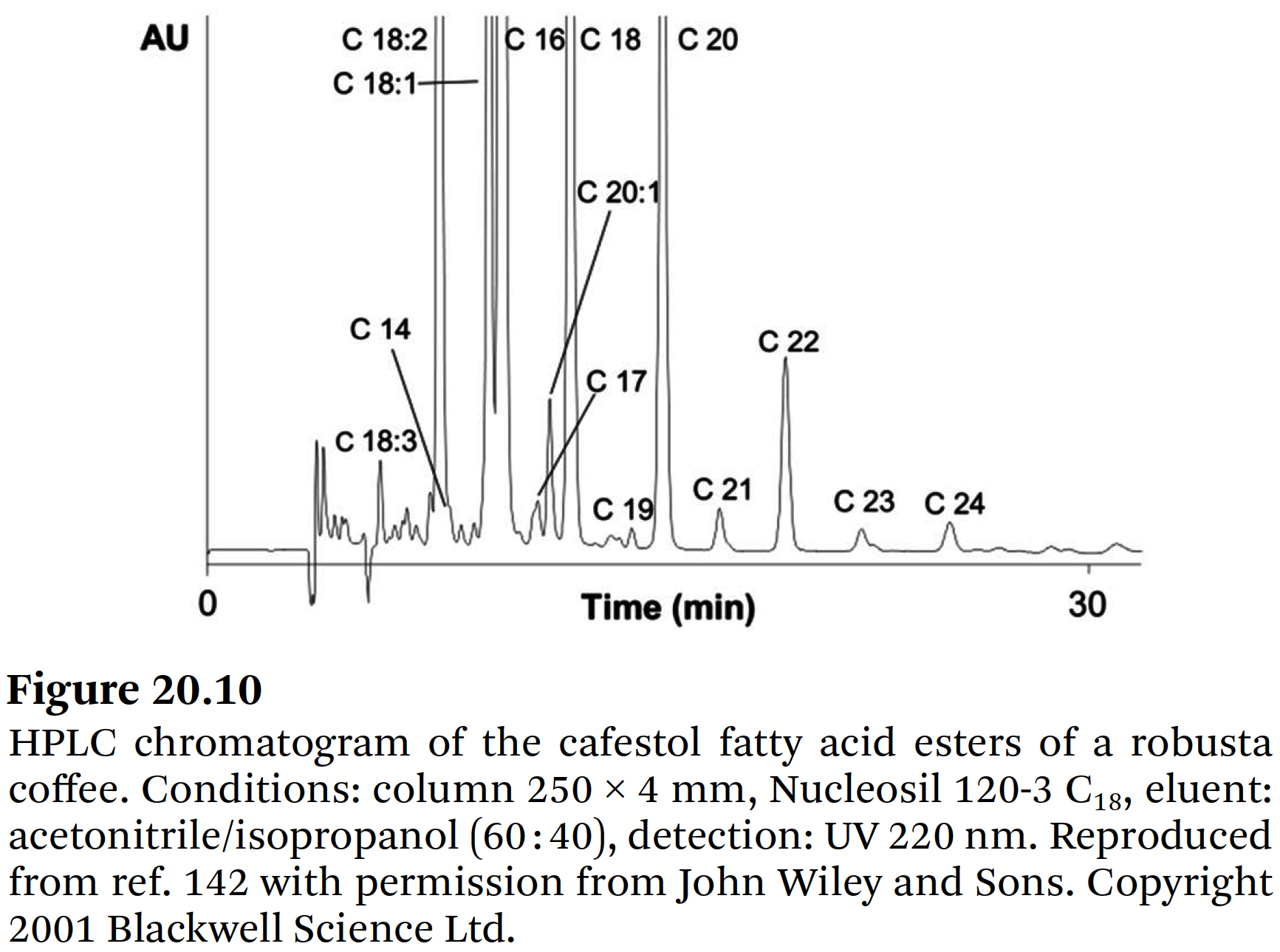

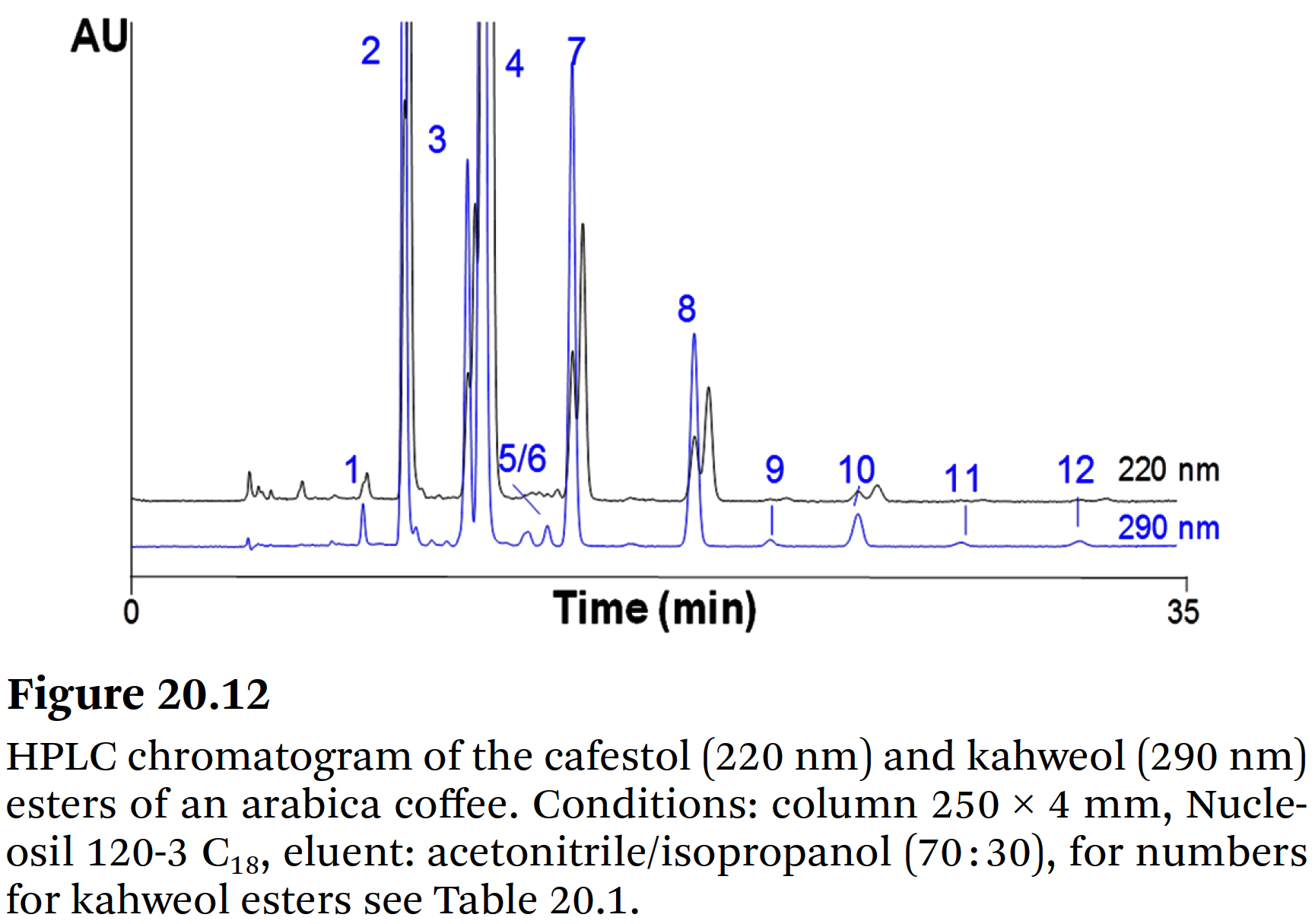

- C14, C16, C18, C18:1, C18:2, C18:3, C20, C22, C24와 같은 지방산을 갖는 cafestol esters와
C20:1 지방산 및 C17, C19, C21, C23과 같은 홀수 번호의 지방산을 갖는 에스테르들이 식별되었다. - 이러한 데이터는 16-OMC를 갖는 지방산들의 경우에서 확인되었으며,
카웨올의 경우에도 유효한 것으로 보인다 [60,61]. - 개별 디테르펜 에스테르는 커피 오일에 불규칙적으로 존재했다.
⇒ 홀수 번호의 지방산 에스테르는 미량 성분인 반면,
⇒ 팔미트산(palmitic), 리놀레산(linoleic), 올레산(oleic), 스테아르산(stearic), 아라키드산(arachidic),
그리고 베헨산(behenic acid)으로 에스테르화된 디테르펜은 더 많은 양으로 존재하여 [56-58],
각 디테르펜의 거의 98%를 차지했다.
20.4.3 Synthesis of Diterpene Esters
- 정량 분석을 위해서는 표준 물질이 필요하다.
⇒ 그러나 遊離 디테르펜(free diterpenes)은 매우 고가이며,
⇒ 디테르펜 에스테르(diterpene esters)는 시중에서 구할 수 없다.
⇒ 따라서 표준 물질은 커피 오일에서 분리하거나 합성해야 한다.
⇒ 이를 위해서, 遊離 디테르펜을 다른 지질 성분들과 함께 커피에서 추출하여
비누화 반응을 통해 분리할 수 있다. - 커피 오일에서 디테르펜 에스테르(diterpene esters)를 분리하는 것은 합성 프로세스보다 더 어려울 수 있다.
⇒ 개별 화합물의 양에 따라 비용이 매우 많이 들 수 있다.
⇒ 따라서 cafestol esters와 16-OMC esters의 합성 방법이 개발되었다. - 디테르펜은 酸에 민감하기 때문에, 에스테르화(esterification)에는 온화한 절차가 필요하다.
- 아인혼 변이체(Einhorn variant)에 따르면 알칼리성 환경에서의 반응이 유리하다.
⇒ 피리딘(pyridine)을 촉매로 사용하면,
알코올은 카르복실산 염화물(carboxylic acid chlorides)을 통해 전환되는데,
이러한 염화물과의 반응은 해당 酸과의 반응보다 훨씬 쉽고 수율이 높기 때문이다. - 카페스톨을 에스테르화하는 기술은 Kaufmann and Hamsagar [13]에 의해 처음 기술되었다.
⇒ 카페스톨은 그 배취(batch)를 냉각하면서,
벤젠과 피리딘(3+1, v/v)의 용매 혼합물에서 지방산 염화물을 통해 전환되었다.
⇒ 개별 에스테르들의 경우에,
그들은 45% (cafestol arachidate and cafestol linolate)에서
55%(cafestol palmitate and cafestol stearate) 사이의 수율을 얻었다.
⇒ 독성학적 이유로, 벤젠(benzene)을 톨루엔(toluene)으로 분배(dispense)한 경우에는,
더 낮은 수율을 얻었다.
⇒ 사용된 화학물질의 양을 거의 변경하지 않고,
Kaufmann and Hamsagar가 기술한 방법에 따라 다양한 cafestol esters를 생산했다 [53]. - 입체 장애가 있는 遊離 히드록시基(free hydroxyl group) 때문에
16-OMC esters의 합성에는 더 강력한 촉매인 4-dimethylaminopyridine이 필요하다.
⇒ 이 물질을 사용하면 피리딘을 촉매로 사용할 때보다
아실化(acylation) 반응이 훨씬 빠르고 수율이 높다.
⇒ 용매로 n-hexane과 pyridine (5+1, v/v)을 사용하여
8가지 다른 16-OMC 에스테르의 합성이 성공적으로 수행되었다 [58].
⇒ 반응 후, 생성된 디테르펜 에스테르(diterpene ester) 뿐만 아니라
遊離 지방산과 전환되지 않은 디테르펜이 반응 용기에 존재한다.
⇒ t-butyl methyl ether와 탄산나트륨(sodium carbonate) 용액 사이의
liquid–liquid extraction을 통해 遊離 지방산을 분리할 수 있다.
⇒ 이후, 실리카겔 컬럼에서 고상 추출(solid-phase extraction)을 통해
그 에스테르로부터 디테르펜을 분리할 수 있다.
⇒ 시료를 컬럼으로 옮긴 후,
먼저 에스테르를 n-hexane과 ethyl acetate (9+1, v/v)의 혼합물로 용출한다.
⇒ 그런 다음, 전환되지 않은 디테르펜을 에틸 아세테이트로 용출하여 추가 합성에 재사용할 수 있다.
⇒ 합성을 통해 얻은 다양한 디테르펜 에스테르의 수율은 Table 20.2에 정리되어 있다.
⇒ 수율은 사용된 디테르펜의 양과 직접적인 관련이 있다.
⇒ 에스테르의 순도(purity)는
질량 분석법과 다이오드 어레이 검출기(diode-array detector)를 연결한 HPLC를 통해 측정했다.
⇒ 또한, 몰 흡광 계수(molar extinction coefficients)를 측정했는데,
이 계수들은 매우 달랐으며 지방산의 구조에 따라 달라지는 것으로 보였다 (Figure 20.13 참조).
⇒ 따라서 정밀한 정량화를 위해서는 여러 개의 개별 에스테르들이 필요하다.


20.4.4 Other Diterpene Compounds
20.4.4.1 Atractylosides
- 커피에서 발견되는 또 다른 중요한 디테르펜 파생체 그룹은
⇒ 아트락틸로사이드(atractylosides) 계열로, 주로 배당체로 존재한다
(Obermann and Spiteller, 1976, Maier and Wewetzer, 1978,
Aeschbach et al., 1982, Bradbury and Balzer, 1999) [62–65]. - Total bean glycoside contents (총 콩 배당체 함량)은 약 1~5 g/kg으로 다양했다.
- 열처리 시, 해당 아트락틸리게닌 배당체(atractyligenin glycosides)로의 탈카르복실화(decarboxylation) 반응이
빠르게 일어났다. - 아트락틸리게닌 배당체는 로스팅에 비교적 안정적이었으며, 다크 로스팅 조건에서는 함량이 약 절반으로 감소했다 [65].
20.4.4.2 Arabiol
- 아라비올(arabiol)에 대해 말하자면,
콜롬비아산 습식 가공 아라비카 커피 생두에서 한 디테르펜 파생체(diterpene derivative)가 추가로 확인되었다. - 이 커피 콩들은
수분 함량(6.2%, 11.5%, 13.8%) 및
온도(12°C, 25°C, 40°C)와 같은 다양한 주요 요인의 조건에서
18개월 동안 특수 포장지에 담아 정해진 대기(산소 함량: 2%, 5%, normal)에서 보관했다
(Speer and Kölling-Speer, 2006).[11] - 신선한 커피 콩들과 달리 크로마토그램에서 추가 신호가 검출되었다 (Figure 20.14).

- 새로운 물질의 구조는
⇒ 1H 및 13C NMR spectroscopy을 통해 결정되었으며,
⇒ 모든 양성자 및 탄소 신호의 정확한 할당은 2D NMR 기술인 COSY, HSQC, HMBC, NOESY를 통해 수행되었다.
⇒ 카페스톨과는 대조적으로, 새로운 화합물은
방향족(aromatic) 또는 올레핀(olefinic) 구조의 다른 수와 배열을 나타낸다. - 1H/13C-correlated HSQC 스펙트럼들은 방향족 영역에 6개의 CH=基를 나타내며,
NOESY 스펙트럼은 양성자 배향을 제공한다.
⇒ 12/13-H, 13/2-H, 2/1-H, 4/3-H correlations를 이용하여
이러한 양성자들의 결합 배위(coordination of the linkage)가 명확해졌다.
⇒ Mass spectrometry와 NMR 데이터를 결합하여, Figure 20.15에 나타난 구조식을 추정할 수 있다.
⇒ 이 물질의 IUPAC 명칭은
8-(hydroxymethyl)-11b-methyl-4b,5,6,7,8,9,10,11,11a,11b-decahydro-6a,9-methanocyclohepta[a]
phenanthren-8-ol이다.
(2002년 ACD/Labs™ IUPAC Name Educators Pack 14.5 버전 6.0 소프트웨어에 따름).
⇒ 본 장의 저자들은 이 이름을 아라비올(arabiol)이라고 제안했다 [66].

20.4.4.3 Coffeadiol
- 표준 물질로서 cafestol의 분리 중에, 새로운 화합물이 검출되었다.
- 실리카겔 컬럼 크로마토그래피와 후속 반분취 RP-HPLC를 사용하여 그 물질을 분리했다.
- 구조 규명은
NMR 분광법(1H-NMR, 13C-NMR, DEPT, COSY, HSQC, HMBC, NOESY),
mass spectroscopy, 그리고 X-ray crystal structure analysis를 통해 수행되었다. - 고분해능 EI 질량 스펙트럼은
⇒ 분자식 C19H30O2를 설명하는 m/z 290.225의 분자 이온 피크를 나타냈다.
⇒ 물과 히드록시메틸(hydroxymethyl)의 연속적인 손실로 인해
m/z 272.215(C19H28O), m/z 259.206(C18H27O), 그리고 m/z 241.195(C18H25))에서
세 개의 더 강한 단편 피크(fragment peaks)가 나타났다. - 13C-NMR 스펙트럼 (Table 20.3)은 새로운 화합물의 탄소 원자 數가 총 19개임을 나타낸다.
⇒ 그 탄소 원자(carbon atoms)는
DEPT 스펙트럼에서 메틸기(methyls) 2개, 메틴(methines) 2개, 메틸렌(methylenes) 10개,
4차 탄소 원자(quaternary carbon atoms) (sp2) 2개,
4차 탄소 원자(quaternary carbon atoms) (sp3) 3개로 확인되었다.
⇒ 두 4차 탄소 원자 사이에 이중 결합이 1개 존재함은
13C-NMR (δ = 129.6 and 126.6 ppm)을 통해 확인되었다. - HMBC 스펙트럼은
⇒ 메틸基 1개(δ=1.612 ppm)의 양성자와
double bond C4, C5, 그리고 C6의 4차 탄소 원자(quaternary carbon atoms) 2개 사이에
강한 교차 피크(cross-peaks)를 보여준다.
⇒ 결과적으로, 이 메틸기는 C5에 위치한다. - NOESY 스펙트럼은
⇒ 메틸 양성자(δ = 0.85 ppm)와 양성자 H8α, H2α, H11α, H16α 사이에 교차 피크를 나타낸다.
⇒ 이는 탄소 원자 C10에 메틸기가 위치하는 것으로만 해석할 수 있다.
⇒ 만약 카페스톨처럼 탄소 원자 C9에 위치한다면,
양성자 H16α를 가진 C10의 NOE 피크는 나타나지 않아야 한다.

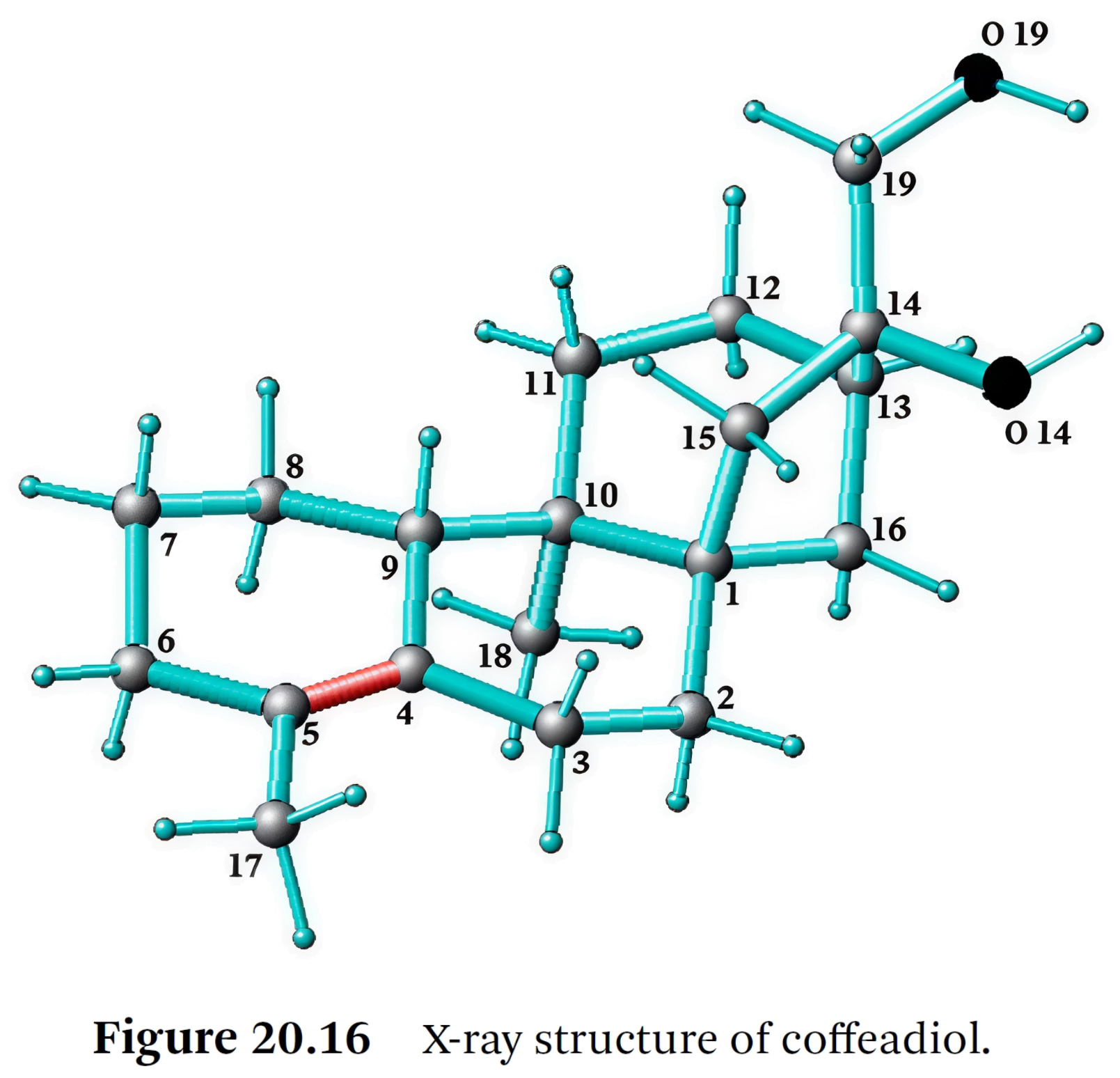
- 결정 구조를 X-ray single crystal method로 분석하여
메틸基(methyl group) C18이 기존 디테르펜과 비교하여 실제로 다른 탄소에 결합되어 있음을 확인했다. - 추정된 구조는 확인되었으며(Figure 20.16), 분석 결과 H bridged dimer의 존재가 나타났다.
⇒ 카페스톨과 비교했을 때, 새로운 구조의 가장 중요한 차이점은
⇒ 푸란 고리(furan ring)의 부재와 메틸기 1개의 위치이다.
⇒ 14-(Hydroxymethyl)-5,10-dimethyltetracyclo-[11.2.1.01,10.04,9]hexadec-4-en-14-ol은
밝은 노란색 결정(융점 110°C)으로 얻어졌다.
⇒ 일반적인 명칭으로 코페아디올(coffeadiol)이 제안되었다 (Kurt and Speer, 1999) [67].
20.4.5 Diterpenes in the Lipid Fraction of Roasted Coffees
- 로스팅 과정에서 여러 가지 새로운 디테르펜 화합물들이 생성된다.
- 로스팅된 커피에서 cafestol과 kahweol의 두 가지 분해 산물인
┌ dehydrocafestol (디하이드로카페스톨)과
└ dehydrokahweol (디하이드로카웨올)이 확인되었다 (Figure 20.17).
⇒ 두 화합물의 함량은 로스팅 온도가 높아질수록 증가하지만,
생두 내 카페스톨과 카웨올의 함량에도 영향을 받는다 [27,68,69].

- 커피의 로스팅 정도에 대한 객관적인 특성을 찾으려면 cafestol/dehydrocafestol 비율이 적합하다;
⇒ 따라서 25~40의 비율은 잘 로스팅된 커피를 의미하고,
15 이하의 비율은 강하게 로스팅된 커피를 의미한다.
⇒ 그러나 더 강하게 로스팅 된 에스프레소 커피의 비율은 10~15.69이다. - Cafestal (카페스탈)과 kahweal (카웨알) (Figure 20.17)은
⇒ 상업용 로스팅 커피에서 검출된 cafestol (카페스톨)과 kahweol (카웨올)의
두 가지 새로운 분해 산물이다 [70]. - high-resolution mass spectrometry와 다양한 NMR 실험을 통해 로스팅 커피에서
⇒ 세 가지 새로운 디테르펜이 확인되었다 [71,72]. - 2005년에는
┌ isokahweol (이소카웨올)과
└ dehydroisokahweol (디하이드로이소카웨올) (Figure 20.18), 그리고 - 2008년에는
⇒ secokahweol(세코카웨올)(Figure 20.19)이 식별되었다. - 강하게 로스팅된 커피 샘플의 일반적인 HPLC 크로마토그램이 Figure 20.20에 제시되어 있다.
- 새로운 컬럼과 예를 들어 UHPLC를 사용하면
분리 효율 저하 없이 6분 이내에 분석을 수행할 수 있다 (Figure 20.21 and Figure 20.22) [73,74].





20.4.6 Diterpenes in Coffee Beverages
- 커피 음료의 센서리 품질은 다양한 요인에 의해 부정적인 영향을 받을 수 있다.
⇒ 건조된 생두는 로스팅 전 최대 3년까지 보관된다는 점을 고려할 때,
보관 조건은 커피 음료의 이취 발생에 영향을 미치는 주요 요인이다.
⇒ 부정적인 향미 변화는
“moldy (곰팡이 냄새)", "earthy (흙 냄새)", "raw-old (오래된 냄새)", "woody (나무 냄새)"로 설명된다.
⇒ 모든 원산 지방들이 후자의 영향을 받는 것은 아니지만,
생두 보관조건이 이러한 유형의 이취를 발생시키는 것으로 추정된다.
⇒ 특히, 지질 분획은 이취 발생의 전구체로 제시된다 [48]. - 여러 연구들에서 특별히 마련된 커피를 섭취하면 혈청 콜레스테롤 수치가 증가할 수 있다고 보고했다.
- 여과되지 않은 커피를 사용하는 국가에서
⇒ 혈청 LDL 콜레스테롤 수치가 높은 경우가 많았기 때문에,
⇒ 이러한 효과는 커피에 존재하는 지질 때문이라고 추론되었다. - 이러한 지질은 물에 잘 녹지 않지만, 우려내는 방법에 따라 커피에 포함될 수 있다.
⇒ 초기에는 triacylglycerides (트리아실글리세리드)가 이러한 효과의 원인으로 여겨졌지만,
⇒ 최근 몇 년 동안 디테르펜(diterpenes), 특히 카페스톨(cafestol)과 카웨올(kahweol)이
遊離 형태와 palmitate esters (팔미트酸鹽 에스테르) 형태로
혈청 콜레스테롤 수치에 영향을 미치는 것으로 밝혀졌다 [76–80].
⇒ 다른 디테르펜은 아직 테스트되지 않았다. - 더욱이, diterpenes (디테르펜)의 긍정적인 효과가 보고된 과학 논문이 상당수 존재한다.[81–84]
⇒ Lam et al. [81]은 카페스톨이
glutathione-S-transferase (글루타치온-S-트랜스퍼라제) 활성을 자극하여
xenobiotica (제노바이오티카)의 분해를 촉진한다는 것을 보여주었다.
⇒ 다른 저자들은 cafestol(카페스톨)과 kahweol(카웨올)이
아플라톡신 aflatoxin B1-유도적 유전독성(genotoxicity)으로부터 보호한다고 보고했다 [82–84].
⇒ 따라서, 다양한 방식으로 마련되는 커피 음료들에서의 디테르펜 존재에 대한 연구는 매우 중요하다 [85–90]. - Sehat et al. [86]은
16-OMC esters를 예로 들어,
친유성 디테르펜 에스테르(lipophilic diterpene esters)가
커피 추출액(coffee infusion)으로 유입되고 인스턴트 커피 과립에서도 검출 가능하다는 것을 보여주었다.
⇒ 음료 내 디테르펜 에스테르의 양은
method of preparation에 따라 크게 달라지며, 커피 브루의 총 지질 함량과 직접적인 관련이 있다.
⇒ 일반 가정용 커피 머신으로 마련한 필터 커피의 경우, 총 지질 함량은 커피 분말 지질의 0.2% 미만이었다.
반대로, 에스프레소를 마련할 때는 그 머신과 선택한 매개변수들에 따라 지질의 2~4%가
미세 분쇄 에스프레소 커피에서 커피 브루으로 분산되었고, 따라서 디테르펜도 마찬가지였다.
⇒ 스칸디나비아 스타일로 커피를 마련했을 때는 커피 분말 지질의 최대 22%가 함유되어 있었다.
⇒ 커피 음료 내 디테르펜의 비율 분포는 로스팅된 커피 분말의 분포와 거의 동일했다. - 2007년 네덜란드 Consumentenbond [91](소비자연합)은
머신에서 마련된 커피가 혈청 콜레스테롤 수치를 증가시킬 수 있다고 보고했다.
⇒ 부정적인 생리적 효과로 인해 커피 추출 시 이러한 성분을 줄이는 조건이 주목을 받고 있다.
⇒ 에스프레소 머신의 시장 점유율이 증가함에 따라, 그 저자들의 연구 목적은 다양한 방법으로 추출된
에스프레소 커피의 카페스톨 함량을 연구하는 것이었다 (Buchmann et al., 2010) [90].
⇒ 상업적으로 로스팅된 아라비카 커피를
산업용 원심분리 그라인더 (VTA6S, Stahwert Mühlenbau, Germany)를 사용하여 분쇄했다.
⇒ 입자 크기 분포는 sieve shaker AS 200 tap (Retsch, Germany)에서 다양한 체(90~1000 μm)를
사용하여 측정했다.
⇒ 커피 브루는 에스프레소 머신를 사용하여 진행했다.
⇒ 그라인드 사이즈(아래 참조) 외에도 다양한 추출 조건으로
물 온도(80, 95, 110℃), 커피 양(6.5, 7.5, 8.5g), 물 양(40, 65, 90ml)을 조절했다.
⇒ 갓 추출한 커피는 즉시 동결건조했다.
⇒ 그런 다음 건조 잔류물을 비누화하고, 비누화할 수 없는 물질을 분리한 후,
자외선 검출기를 갖춘 HPLC로 카페스톨을 정량했다.
⇒ 비교 가능한 조건을 확보하기 위해, 이 연구 전체에 걸쳐 로스팅된 아라비카 커피 한 잔을 사용했다.
⇒ 카페스톨 함량은 0.46g/100g으로 측정되었다.
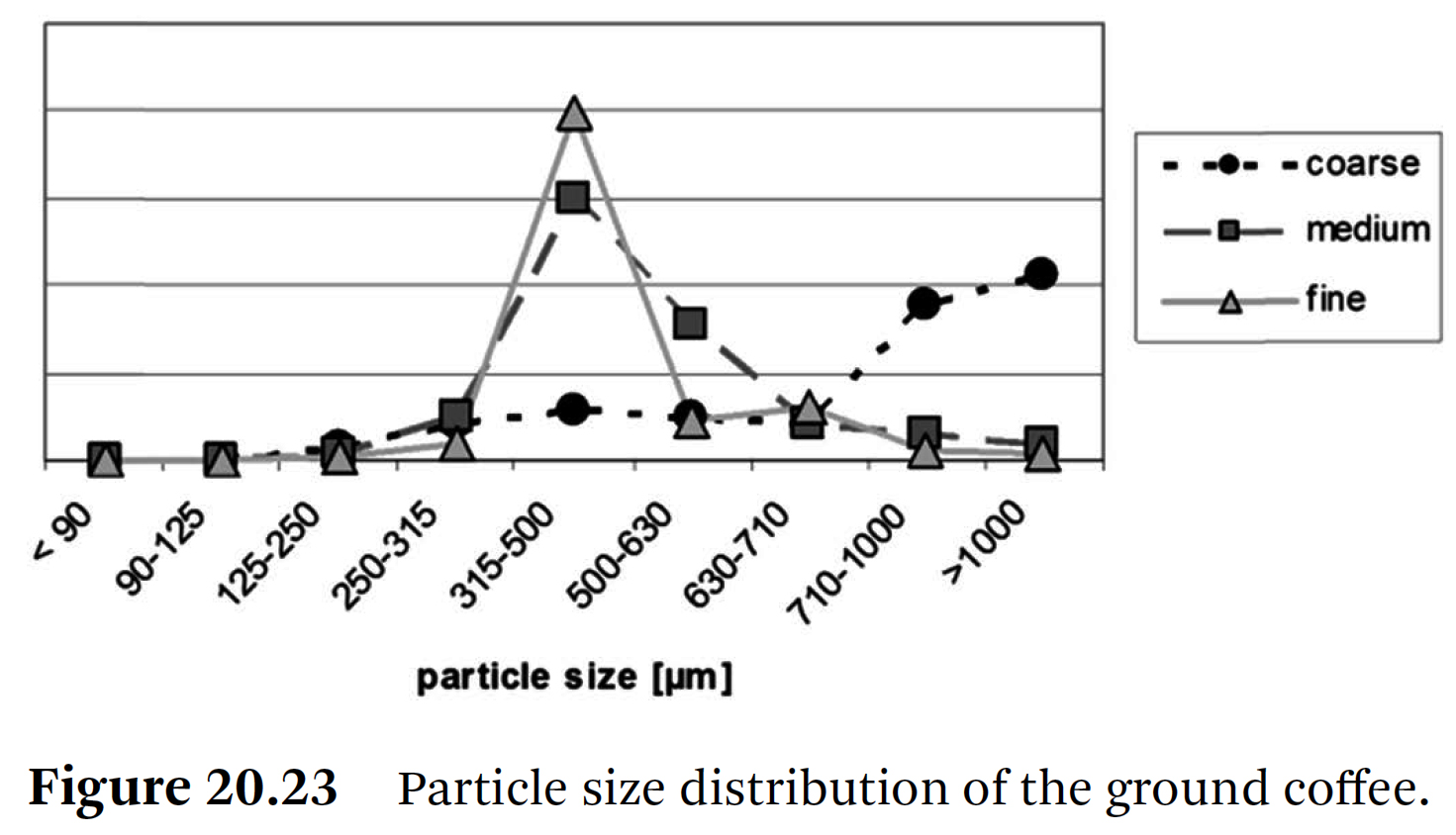
⇒ 로스팅된 아라비카 커피 원두를 원심분리형 분쇄기(centrifugal mill)를 사용하여 세 가지 설정으로 분쇄했다.
⇒ 얻어진 전하량을 입자 크기 분포와 관련하여 분석했다.
⇒ 곱게 분쇄된 커피와 중간 분쇄된 커피 사이에는 분명히 약간의 차이만 있었다.
⇒ 주요 입자 크기는 315~500μm였다.
⇒ 중간 분쇄된 커피는 입자 크기가 500~630μm 사이에서만 차이가 있었다.
⇒ 이와 대조적으로, 거칠게 분쇄된 커피는 주로 700μm보다 큰 입자로 구성되었다 (Figure 20.23).
- 7.5g의 분쇄 로스트 커피로 마련된 95℃의 물 65ml로 뽑은 에스프레소 음료에 대해 분쇄도의 영향을 연구했다.
⇒ 입자 크기가 미세할수록 추출 수율이 높았다 (Figure 20.24).
⇒ 카페스톨 함량과 관련하여, 특히 중간 분쇄 등급과 거친 분쇄 등급 간의 차이가 현저했다.
컵당 2mg에서 0.6mg으로 감소한 것으로 관찰되었다.
그러나 에스프레소의 경우, 거친 분쇄 커피는 적용할 수 없었다.
⇒ 따라서 중간 분쇄 등급과 미세 분쇄 등급을 사용하여 다음 연구를 수행했다.

- 통계적 스크리닝 디자인을 사용하여 추출 매개변수들을 최적화하고
주효과(main effects), 상호작용 효과(interaction effects), 그리고 이차효과(quadratic effects)를 평가했다.
⇒ 유의한 요인들을 파악한 후, Box–Behnken design을 사용하여 최적의 작업 조건을 도출했다.
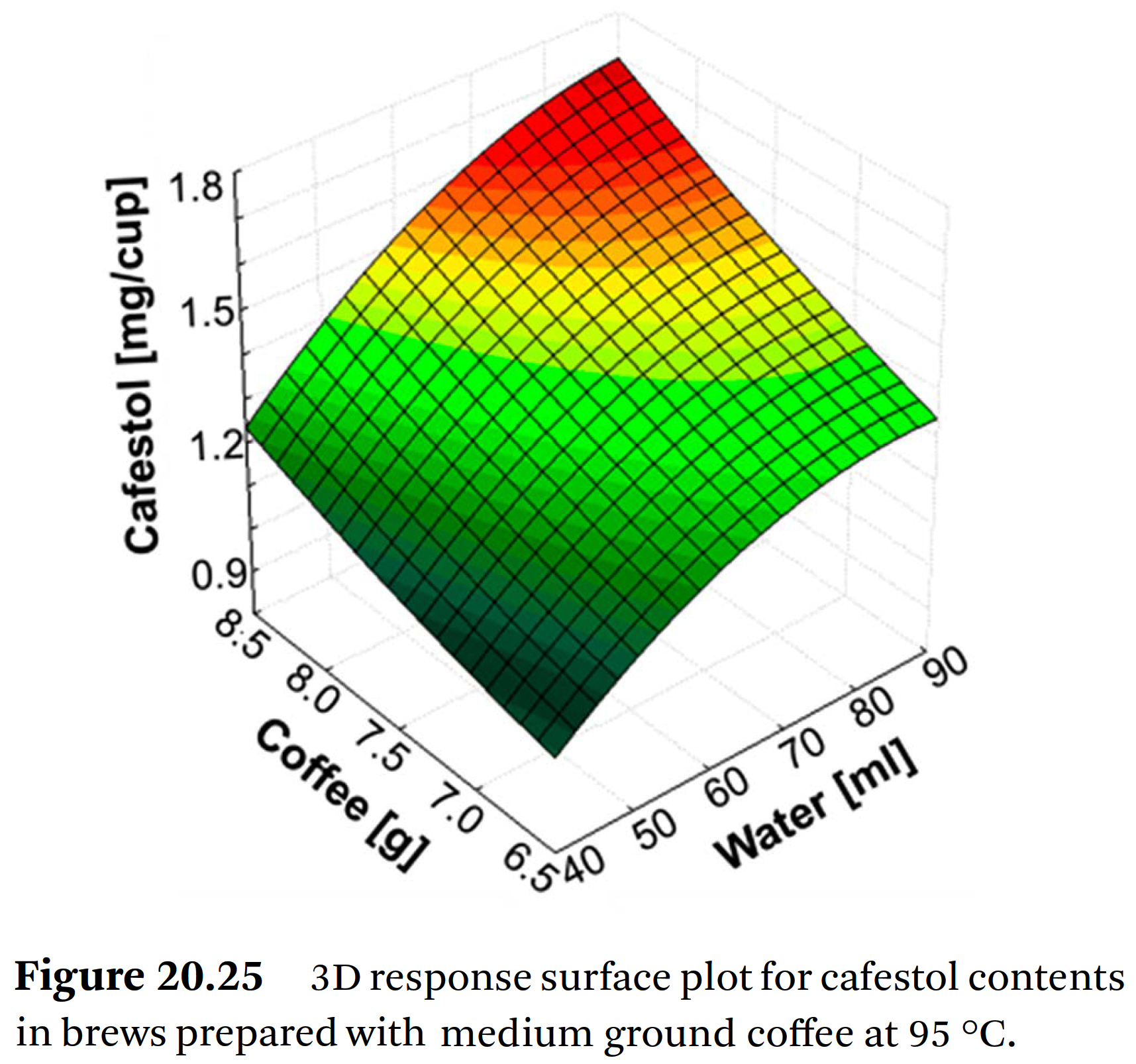
⇒ Figure 20.25는 중간 분쇄도에 대한 3차원 반응 표면도를 보여준다.
⇒ 커피의 양이 증가함에 따라 카페스톨 수율은 거의 선형적으로 증가했다.
⇒ 특히 물의 량이 동시에 증가함에 따라 에스프레소 추출에서 카페스톨 추출 수율이 최대치에 도달했다.
- 예상대로, 곱게 분쇄된 커피는 전반적으로 카페스톨 함량이 더 높았다.
⇒ 곱게 분쇄된 커피 분말의 표면적이 넓어짐에 따라 추출 수율이 증가했다 (Figure 20.26).
⇒ 8.5g의 커피와 90ml의 물에서 2.7mg의 카페스톨을 추출하는 가장 높은 수율을 보였다.
⇒ 중간 분쇄 등급과는 대조적으로, 물 양을 늘리고 커피 양을 일정하게 유지한 경우,
카페스톨 함량은 약간만 감소했다. - 입자 크기(particle size) 외에도
⇒ 커피/물 비율이 추출액의 카페스톨 함량에 영향을 미치는 가장 중요한 요인인 것으로 나타났다.
⇒ 에스프레소 음료의 추출 파라미터들을 변경함으로써, 카페스톨 함량은
컵당 2.6mg (110°C에서 중간 분쇄 커피 분말 10g, 물 180mL)에서
컵당 0.9mg (80°C에서 거칠게 분쇄 커피 분말 8g, 물 70mL)으로 감소했다. - 그러나 카페스톨 함량이 낮고,
결과적으로 지질 함량도 낮은 커피 음료는 커피 소비자의 감각을 만족시키지 못할 것이다. - 따라서 카페스톨 함량과 감각적 인상(sensory impression) 사이에서 적절한 타협점을 찾아야 한다.

20.5 Sterols
- 지난 몇 년 동안 식물성 스테롤(phytosterols)은 그 유익한 특성으로 인해 더욱 중요해졌다.
- 피토스테롤은 콜레스테롤 수치를 낮추고 항암 효과도 있는 것으로 보고되었다.
- 또한, 면역 조절 효과도 보고되었다 [92,93].
- 커피 오일에는 다른 종자유에서도 흔히 발견되는 여러 스테롤들이 함유되어 있다.
- 4-desmethylsterols 외에도 다양한 4-methyl- and 4,4-dimethylsterols가 식별되었다.
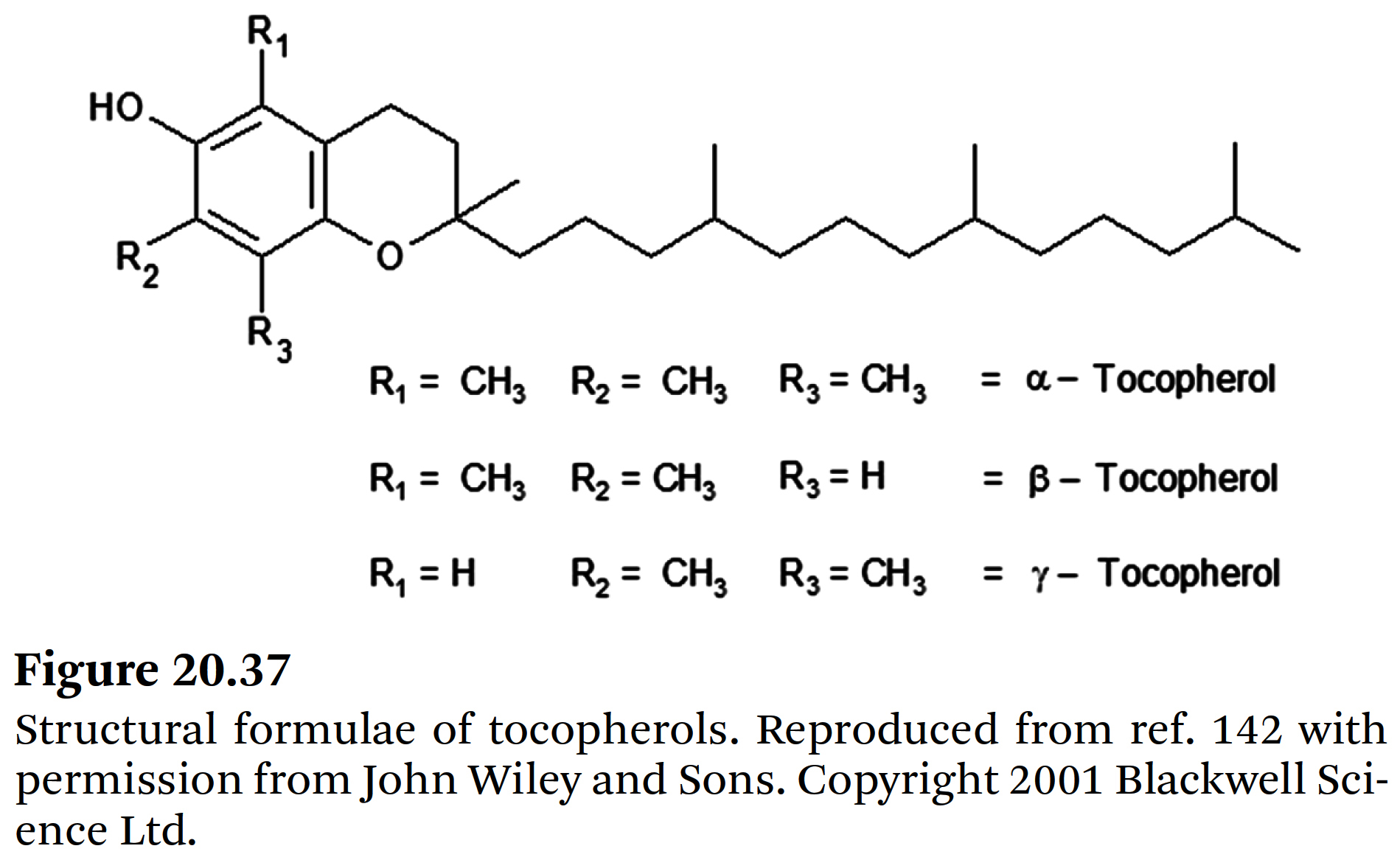
- 주요 스테롤들의 구조식은 Figure 20.27~20.29에 제시되어 있다.



- 커피 오일의 스테롤들은
⇒ 遊離 형태(약 40%)와
에스테르 형태(약 60%)로 모두 기술되었다(Picard et al., 1984) [4]. - 불검화물(unsaponifiable matter)에서의 그 총량이 GC 또는 GC/MS를 이용하여
TM-derivatives로서 측정되었다. - 종종 TLC, HPLC 또는 실리카겔 카트리지를 사용하여,
데스메틸(desmethyl), 4-메틸 및 4,4-디메틸스테롤(dimethylsterols)에서
분획화가 수행되었다 (Alcaide et al., 1971, Itoh et al., 1973, Picard et al., 1984, Horstmann and Montag, 1986, Homberg and Bielefeld, 1989, Speer, 1989) [4,6,94–98]. - Desmethylsterols (데스메틸스테롤)은
⇒ 총 스테롤 분획(total sterol fraction)의 90%를 차지하며,
이는 지질의 1.5%에서 2.4% 범위였다 (Picard et al., 1984) [4];
⇒ Nagasampagi et al. (1971)은 5.4%로 더 높은 함량을 보고했다 [99]. - 다양한 로부스타 및 아라비카 커피 샘플의 주요 desmethylsterols 분포가 Table 20.4에 나와 있다.
- 주요 스테롤은 약 50%를 차지하는 β-sitosterol (시토스테롤)이며,
그 다음으로 stigmasterol (스티그마스테롤), 캄페스테롤(campesterol), 그리고
Δ5-avenasterol (아베나스테롤)이 있다. - 이 중 Δ5-avenasterol은
⇒ 아라비카 커피보다 로부스타에서 훨씬 더 많이 발견되며,
⇒ 로스팅 과정에서도 높은 안정성을 유지하여 커피 블렌드 연구에 적합하다
(Duplatre et al., 1984, Saltor et al., 1989, Frega et al., 1994, Valdenebro et al., 1999,
Dussert et al., 2008) [28,100~103].
⇒ 로부스타 콩들은 아라비카 콩들 보다 Δ5-avenasterol 함량이 5배 더 높다
(1.7g 100g−1 vs. 350mg 10kg−1, Kamm et al., 2002) [31]. - 그러나 다양한 천연 함량으로 인해 아라비카 커피 혼합물 내의 로부스타 부분을 결정하는데는
약 20% 이상만 적합하다. (diterpene 섹션 참조).

- Picard et al.[4]는
⇒ free sterols와 sterol fatty acid esters를 컬럼 크로마토그래피 (aluminium oxide 산화알루미늄)를
이용해 분리했다.
⇒ 12가지 로부스타 커피 샘플들을 분석하면서, 그들은
total sterols에 비해 main sterols의 경우에 변화된 분포를 발견했다.
⇒ Free sterols의 경우에, 그 순서는 stigmasterol > β-sitosterol > campesterol이었고,
⇒ sterols esters의 경우에는 β-sitosterol > campesterol > stigmasterol의 순서였다.
⇒ Picard et al.는 또한 sterol esters 내의 개별 지방산들을 연구했다.
⇒ C18, C16, 그리고 C18:1이 주요 화합물들이었고, 구성비율 분포는 triglycerides에서 보고된 것과 비슷했다.
⇒ Cholesterol, campesterol, stigmasterol, β-sitosterol, stigmastanol, Δ5-avenasterol,
Δ7-stigmastenol, Δ7-avenasterol, citrostadienol, gramisterol, cycloartenol, 그리고
traces of 24-methylenecycloartenol이 식별되었고
⇒ 여러 coffee infusions, 즉
Scandinavian style coffee, espresso, 그리고 filtered coffee에서 정량화되었다 [105]. - 식품 및 식이 보충제에 스테롤 글루코사이드(sterol glucosides)가 존재한다는 것이
Phillips et al.[106]에 의해 입증되었다. - 최근 Buchmann et al.[107]에 의해
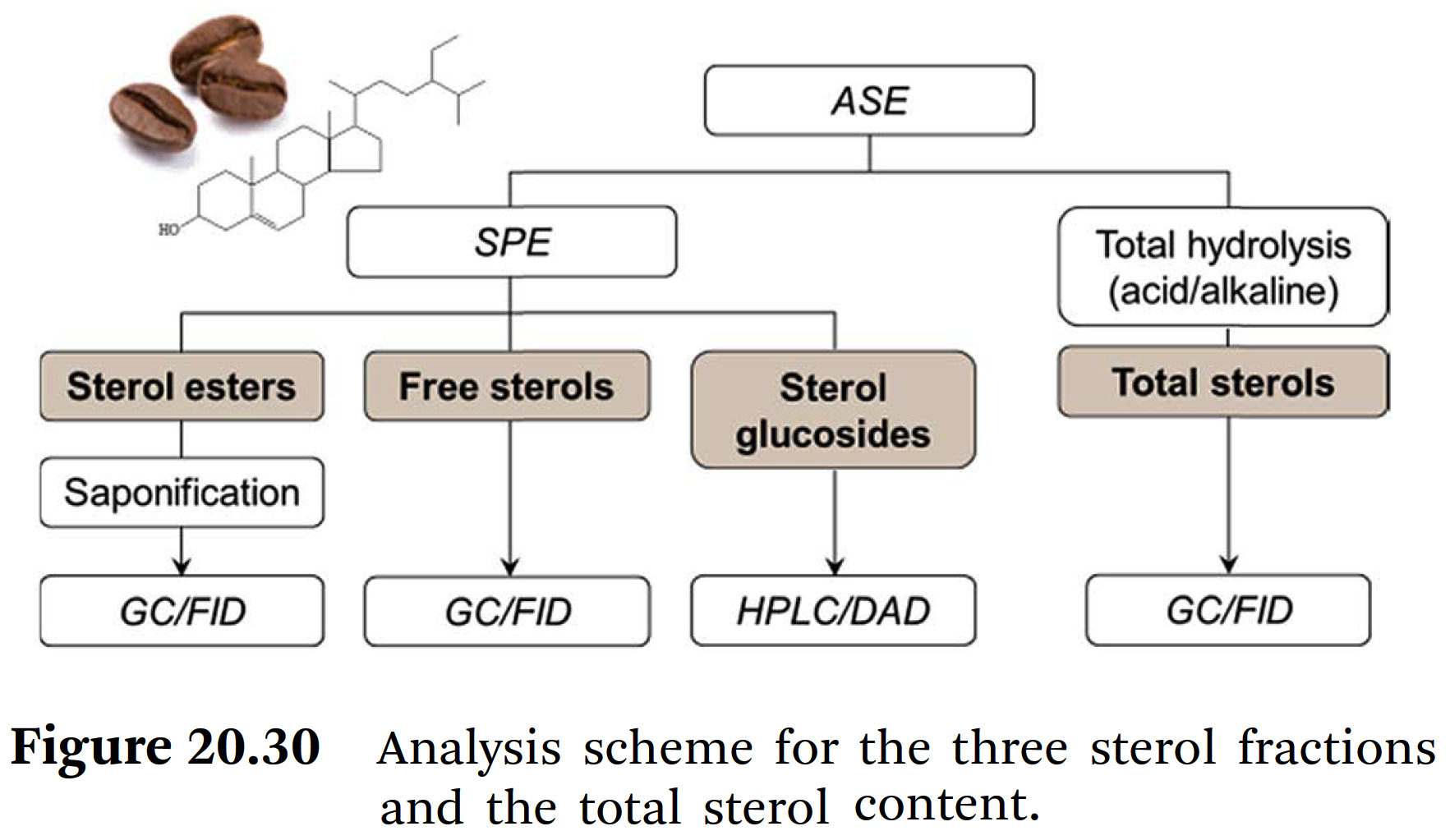
⇒ 아라비카와 로부스타 커피 생두에서 스테롤 글루코사이드가 처음으로 분리 및 분석되었다. - Figure 20.30은
⇒ Oelschlägel et al.[108]이 호박유(pumpkin oils)의 free sterols와 esterified sterols (에스테르化 스테롤)에
대해 처음 개발한 수정된 분석 체계를 보여준다.
⇒ 세 가지 스테롤 분획을 얻었는데,
첫 번째는 sterol fatty acid esters(스테롤 脂肪酸 에스테르)를 함유하고,
두 번째는 free sterols (遊離 스테롤)을 함유하고,
세 번째는 sterol glucosides (스테롤 글루코사이드)를 함유하고 있다.
⇒ 스테롤 脂肪酸 에스테르는 비누화(saponification) 및 誘導體化(derivatization) 후 분석하였고,
遊離 스테롤은 GC/FID를 통해 실릴化(silylation) 후에 분석하고 나서
β-sitosterol를 통해 정량화했다.
⇒ 스테롤 글루코사이드의 분리는
다이오드 어레이 검출기(diode array detector)가 장착된
Phenomenex Synergi 4 μ Fusion 250×3 mm에서 수행되었다.
⇒ 정량 분석은 분자 내 이중결합(double bounds) 수에 따라 β-sitosterol 또는 stigmasterol을
사용하여 수행되었다.
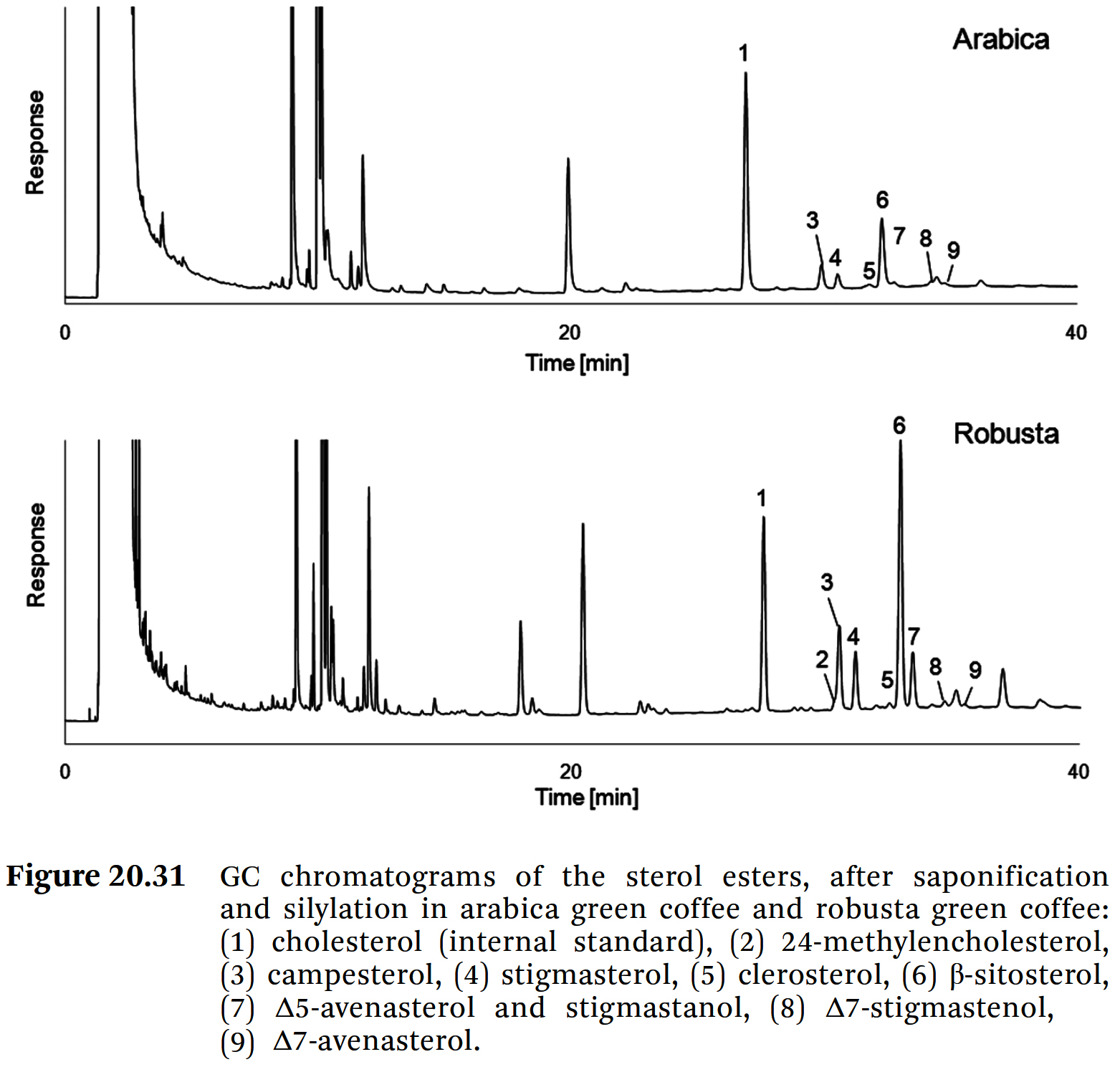
- 아라비카 커피 생두와 로부스타 커피 생두에서 얻은
스테롤 에스테르(sterol ester) 분획의 전형적인 GC chromatograms는
Figure 20.31에 trimethylsilyl (TMS) derivatives로 표시되어 있다. - 후속 스테롤 글루코사이드(sterol glucosides)의 HPLC chromatograms는
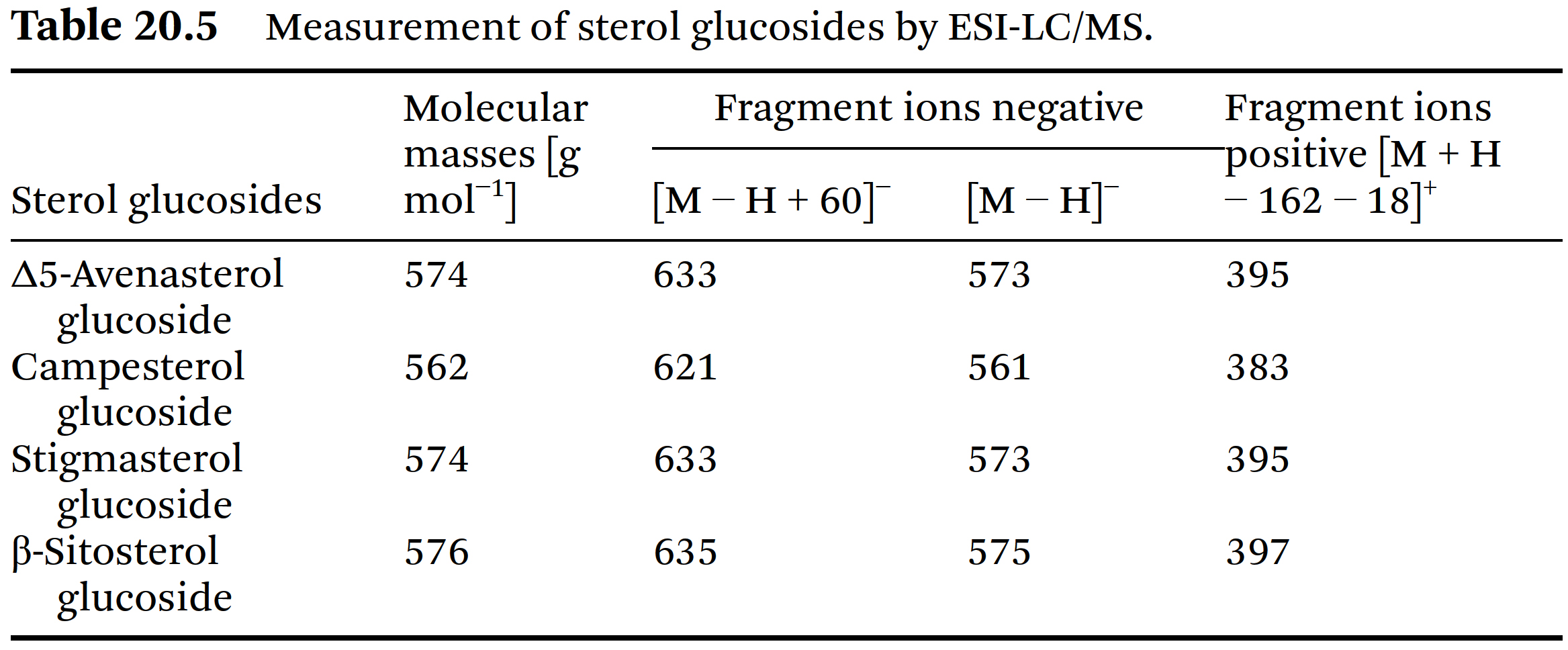
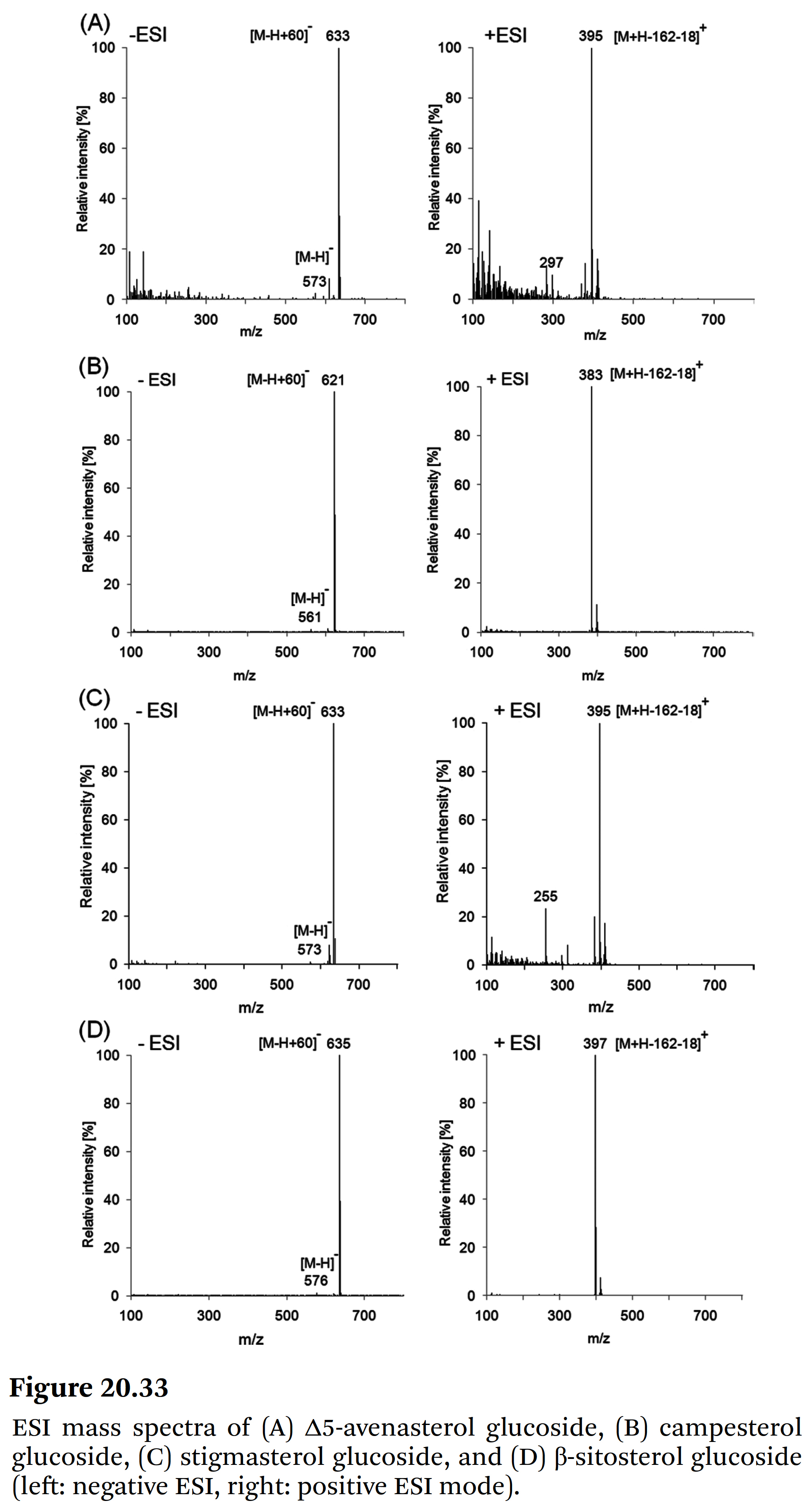
Figure 20.32에 제시되어 있다. - 식별된 sterol glucosides의 중요한 ESI mass spectrum 데이터는 Table 20.5에 나와 있다.
- Figure 20.33은
HPLC로 정량화된 검출된 스테롤 글루코사이드의 ESI 질량 스펙트럼을 보여준다.
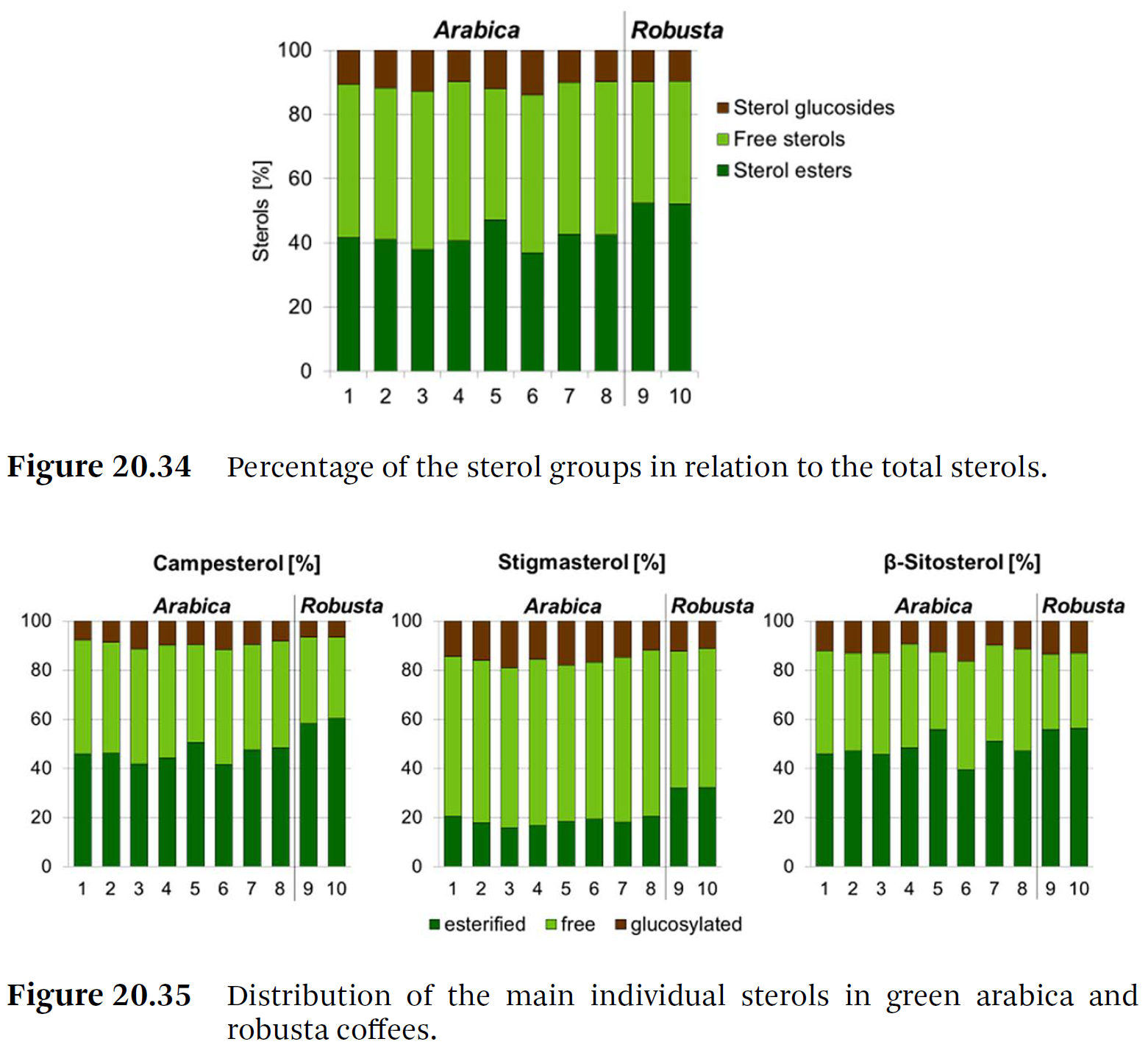
Total sterols의 8%에서 12%가 sterol glucosides였다. - 결과적으로 sterol fatty acid esters가 주요 분획(main fraction)을 대표하고,
그 다음으로 free sterols이 나타난다 (Figure 20.34). - 생두들의 주요 개별 스테롤들에 대한 세 그룹의 퍼센트 分布가 Figure 20.35에 제시되어 있다.
- stigmasterol의 분포는 β-sitosterol 및 campesterol의 분포와 다르다는 것이 분명해진다.
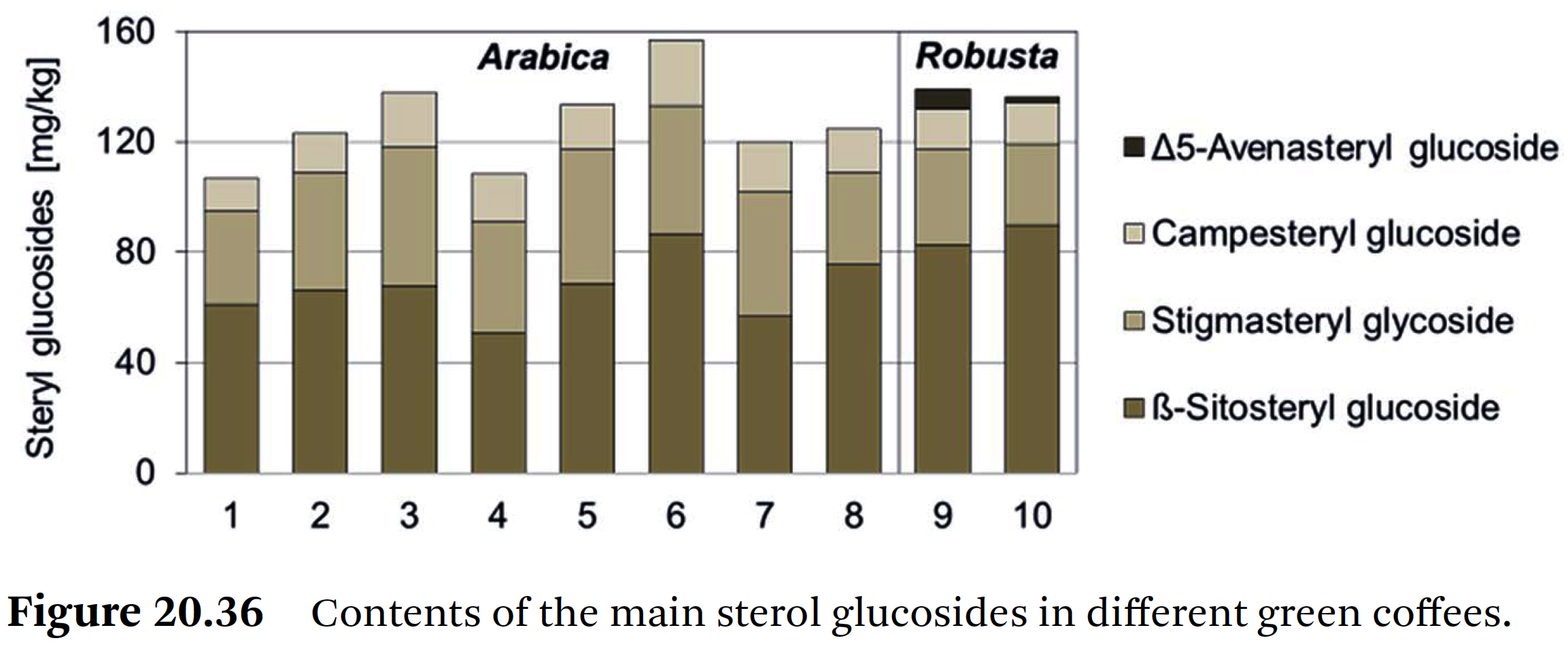
- 네 가지 스테롤 글루코사이드의 개별 함량은 Figure 20.36에 나타나 있다.

20.6 Tocopherols
- 커피 오일에 토코페롤(tocopherols)이 존재한다는 사실은 Folstar et al.[109]에 의해 처음으로 보고되었다;
α-tocopherol은 명확하게 식별되었고,
TLC와 GC로 분리되지 않은 β- tocopherol과 γ-tocopherol은 하나의 그룹으로 간주되었다 (Figure 20.37). - Cros et al. [110] 또한 HPLC로 β-tocopherol과 γ-tocopherol을 합하여 측정했다.
- Folstar et al. [109]는
α-tocopherol의 농도가 89~188 mg kg-1 oil이고,
β-tocopherol과 γ-tocopherol의 농도가 252~530 mg kg-1 oil 임을 확인했다.
- 1988년, Aoyama et al. [111]은
다양한 종류의 커피 콩들에서 α-, β-, γ- tocopherols을 분석했는데, 총 함량은 5.5–6.9 mg/100 g−1 coffee 이었다. - Ogawa et al. [112]은
HPLC를 이용하여 14종의 생두, 그들의 볶은 원두, infusions(우려낸 액), 그리고
38가지의 인스턴트 커피에서 토코페롤 함량을 측정했다.
⇒ 생두의 총 토코페롤 함량은 최대 15.7mg/100-1 g이었고, 평균은 11.9mg/100-1 g이었다.
⇒ α- 및 β-토코페롤 함량은 각각 2.3~4.5mg/100-1 g과 3.2~11.4mg/100-1 g이었다.
⇒ γ- 및 δ-토코페롤은 검출되지 않았다.
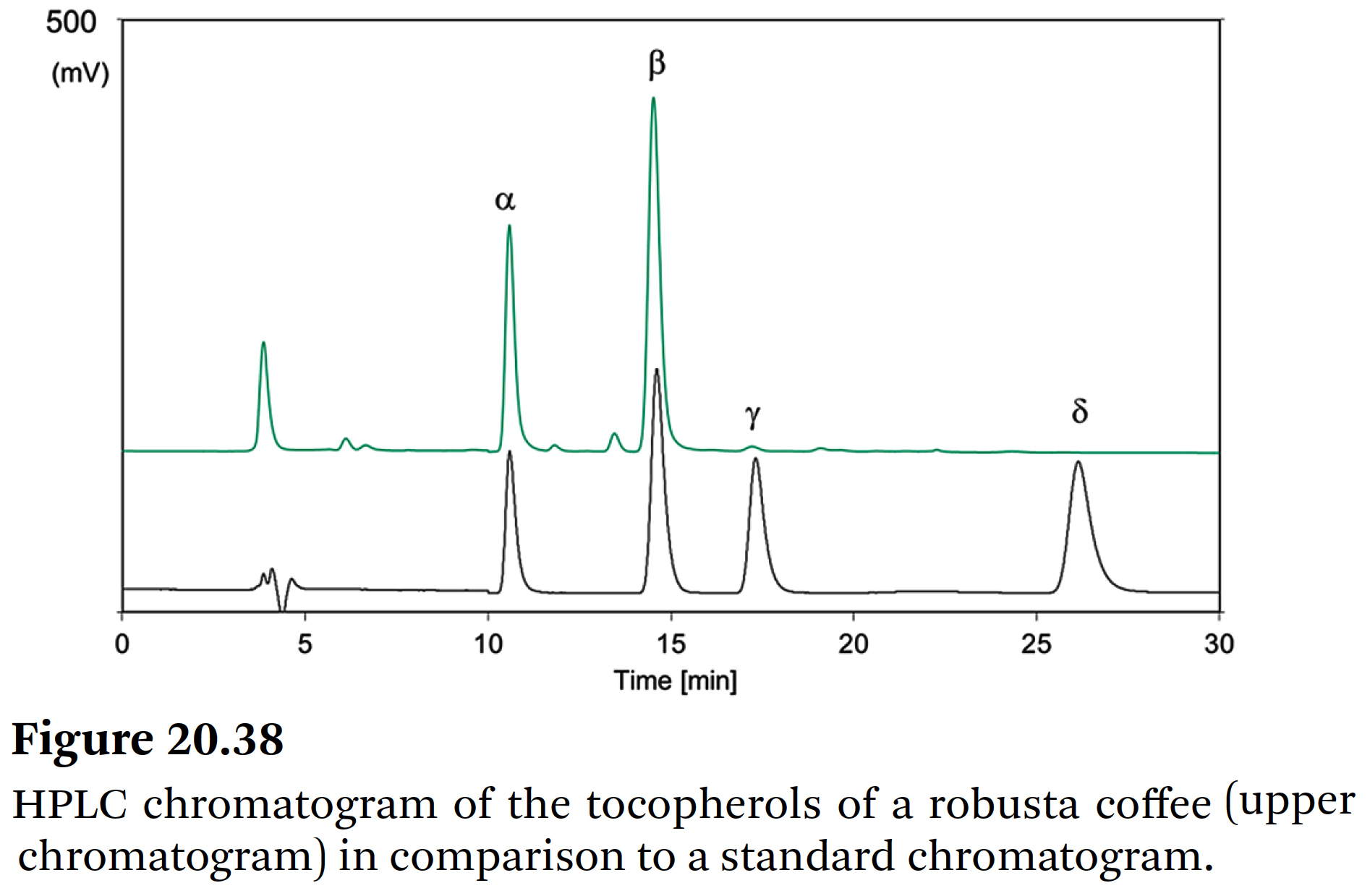
⇒ 로스팅은 α-, β-토코페롤 및 총 토코페롤의 함량을 각각 79~100%, 84~100%, 83~99%로 약간 감소시킨다. - GC-MS와 HPLC를 사용하여 Speer & Kölling-Speer는
일부 로부스타 커피에서 γ-토코페롤을 검출했다 (Figure 20.38) [113]. - González et al. [114]의 결과는
⇒ 생두보다 로스팅 된 커피에서 γ-토코페롤 함량이 더 높다는 점에서 약간 이해하기 어렵다.
20.7 Coffee Wax
- 생두 표면에는 얇은 왁스층(thin waxy layer)이 덮여 있다.
- 커피 왁스(Coffee wax)는
일반적으로 염소계 유기 용매를 사용하여 커피 콩들로부터 추출에 의해 얻어진 물질로 정의된다. - 표면 왁스의 양은 생두 100g−1당 약 0.2~0.3g이다.
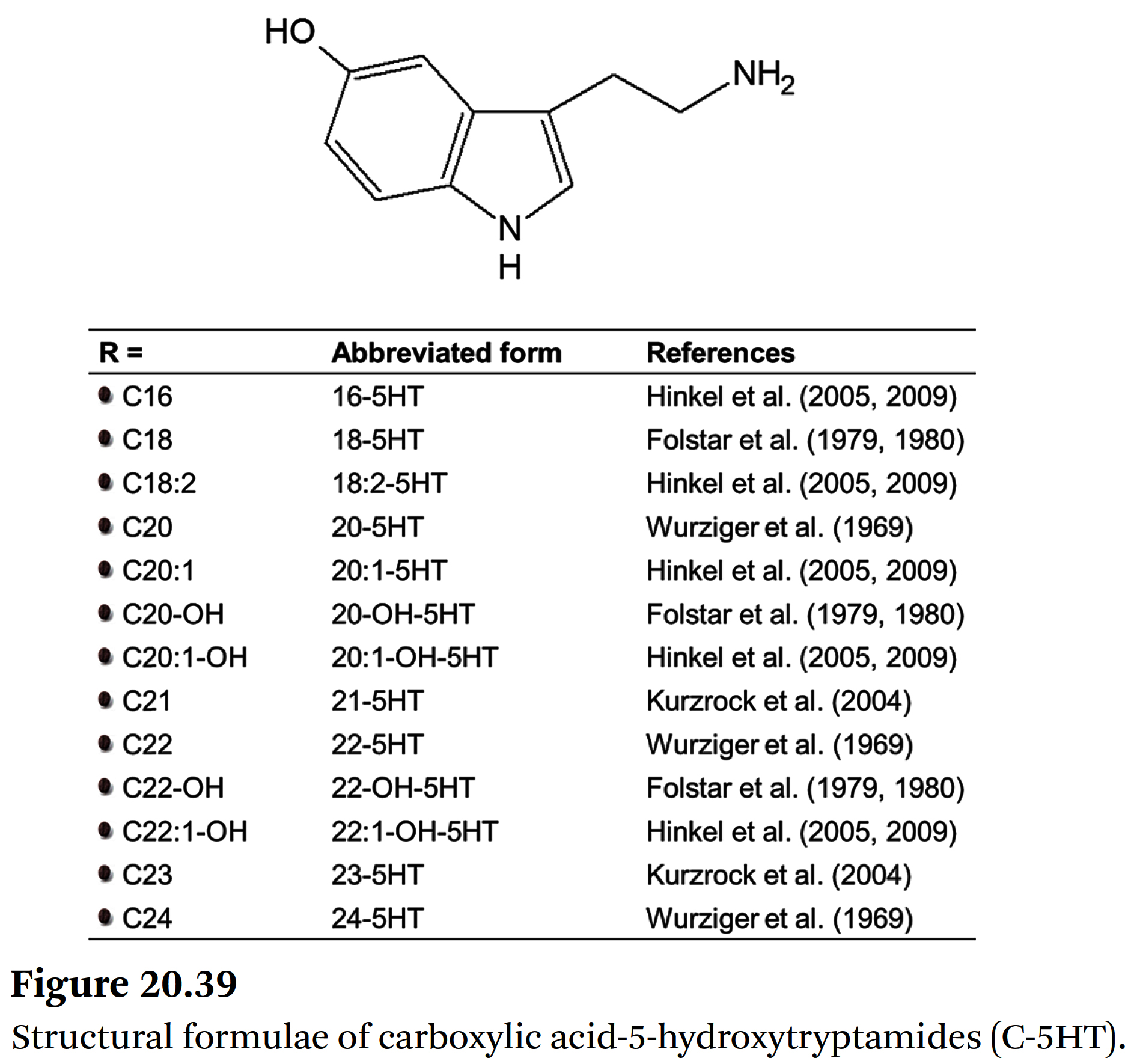
- 커피 왁스의 주요 성분은 ➡ 소위 carboxylic acid-5-hydroxytryptamides (C-5HT)이다.
- 세로토닌의 아미드들(amides of serotonin) (5-hydroxytryptamine, 5HT) 그리고
다양한 사슬 길이의 지방산들의 아미드인 이 물질군은
Wurziger와 동료들에 의해 처음 소개되었다 [115,116].
⇒ 그들은 arachidic acid (아라키드산)(C20),
behenic acid (베헨산)(C22),
lignoceric acid (리그노세르산)(C24)을 가진
세 가지 5HT를 분리하고 특성 분석했다 (Figure 20.39). - 나중에 Folstar는
stearic acid-5HT 뿐만 아니라
20-hydroxy-arachidic-acid-5HT 및
22-hydroxy-behenic acid-5HT도 설명했다 [117,118].
- 여러 연구팀이 생두, 볶은 커피, 그리고 다양한 처리 과정을 거친 커피들의
C-5HT 함량을 측정하는 분석 방법을 개발했다. - 처음에는
thin layer chromatography with spectral photometric or
densitometric determination (분광 광도계 또는 농도계로 측정하는 박막 크로마토그래피)로 분석한 후 [122~124],
liquid chromatography with UV detection at 278 nm로 분석했다 [117,125,126]. - 280nm 여기 파장(excitation wavelength)과
330nm 방출 파장(emission wavelength)에서
형광 검출(fluorescence detection)를 이용한 HPLC 분석 외에도, LC-MS/MS 분석법도 제시되었다 [119-121]. - Figure 20.40은 ➡ 로부스타 커피의 C-5HT에 대한 일반적인 HPLC 크로마토그램을 보여준다.
- 분쇄된 콩들은 가속 용매 추출법(accelerated solvent extraction)(ASE)을 사용하여 추출하였고,
주입 전에 고체상 추출법(solid phase extraction)(SPE)으로 추출물을 정제하였다 (Hinkel and Speer, 2005) [121].
⇒ 이 방법의 recovery rate은 약 90%,
limit of detection은 2.5 mg kg−1, variation coefficients는 5% 미만이었다.
⇒ C-5HT 함량은 합성 표준물질(DE-특허 102008025893 A1)128을 기반으로 계산하였으며,
다양한 처리 시료와의 비교를 위해 모든 값은 건조 중량을 기준으로 하였다.
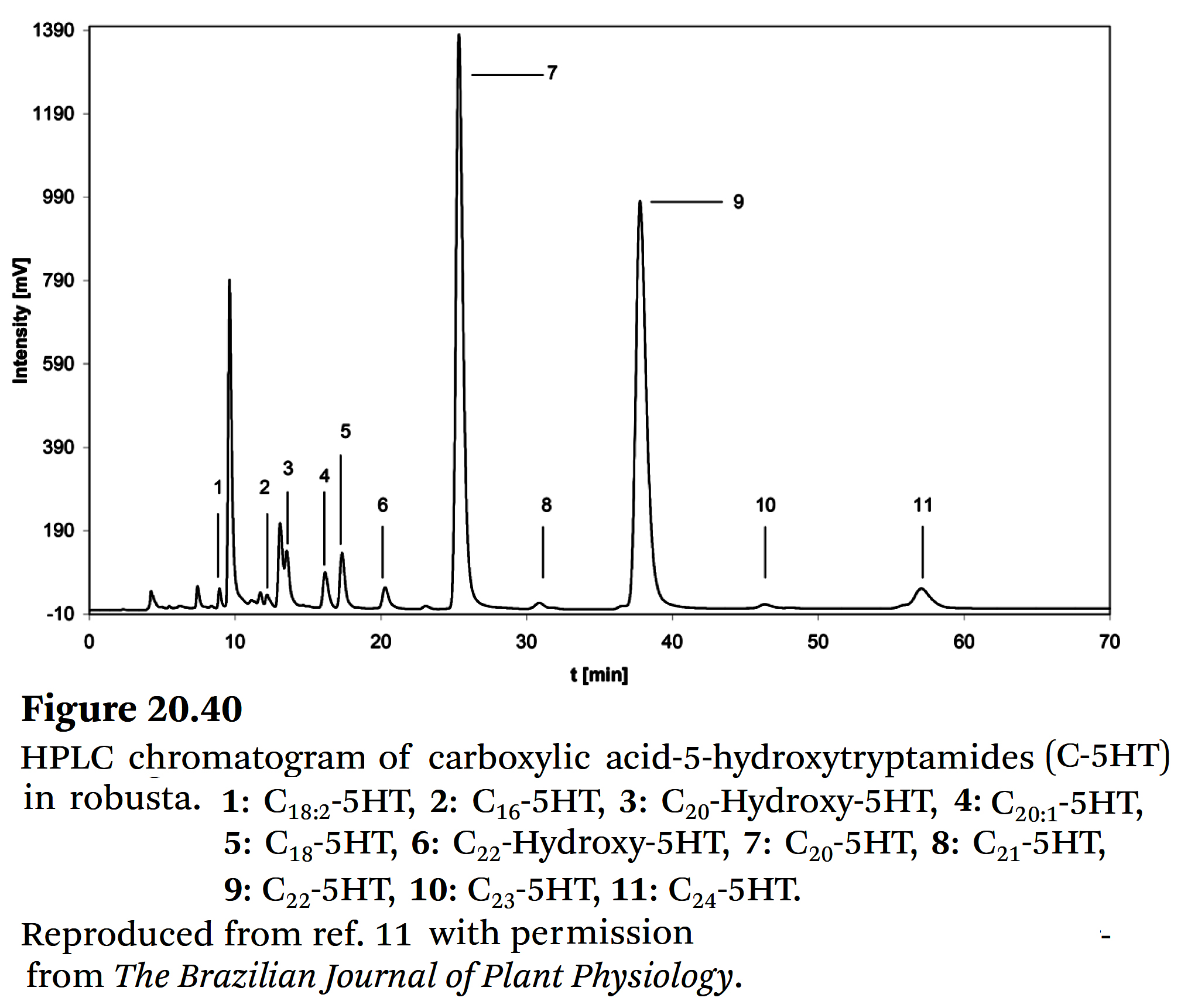
- 크로마토그램의 처음 15분 동안에는 하이드록시 및 불포화 지방산(hydroxy and unsaturated fatty acids)을 함유한 C-5HT가 용출되는 반면,
포화 지방산(saturated fatty acids)을 함유한 C-5HT는 retention times가 18분 이상이다. - Arachidic acid-5-hydroxytryptamide와
behenic acid-5-hydroxytryptamide dominate, 그리고 기타 아미드들은 미량 성분이다. - Figure 20.41에서는
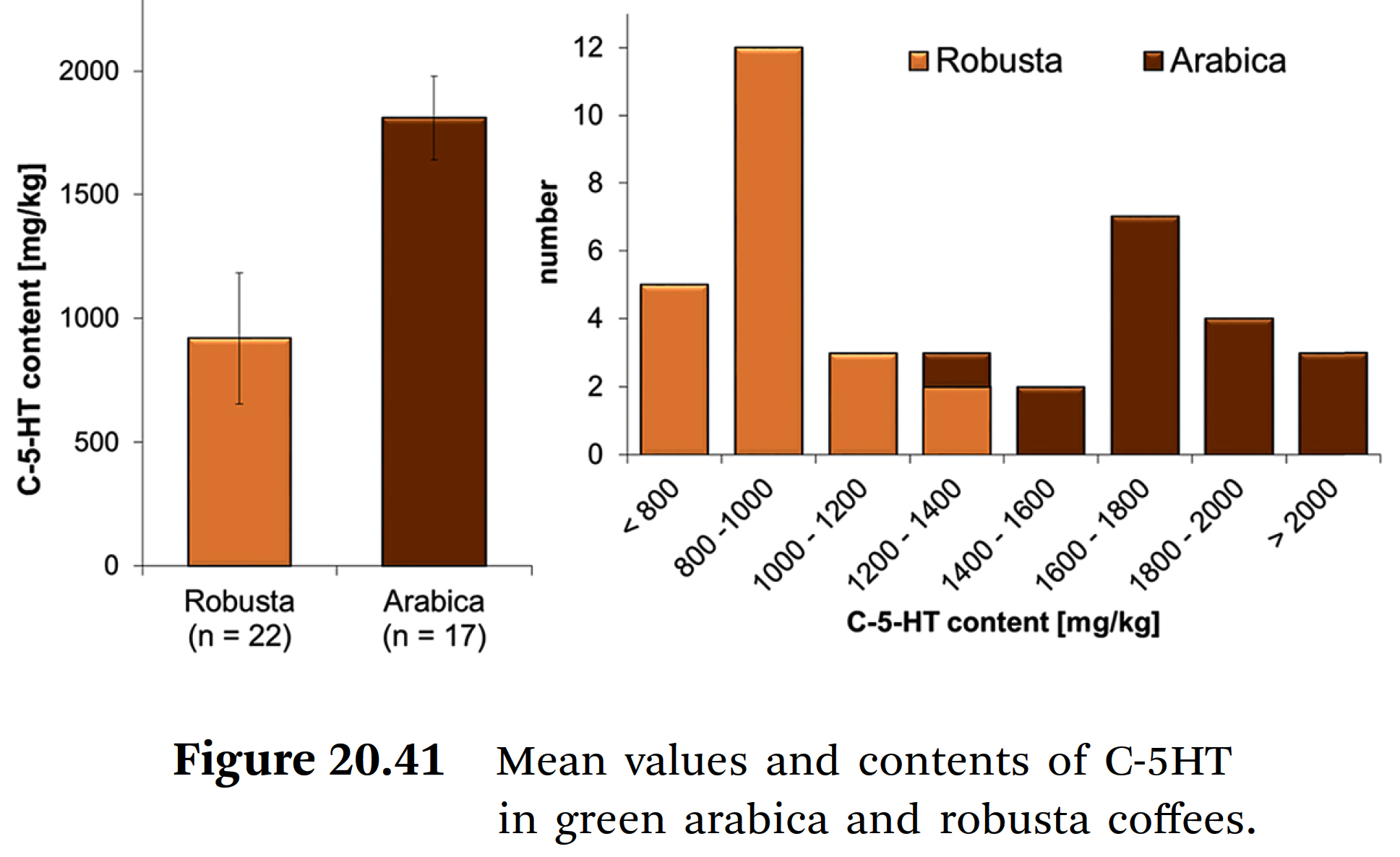
➡ 로부스타와 아라비카로 구분된, 분석 커피 생두 샘플들의 표준 편차를 포함하여 총 함량을 제시한다.
⇒ C-5HT의 총 함량과 관련하여, 아라비카 커피의 양은 로부스타 커피의 양보다 거의 두 배 높았다.
⇒ 두 種 간의 차이는 다양한 커피들의 C-5HT 量 분포와 관련하여도 분명해졌다.
⇒ 분석된 로부스타 커피의 약 90%가 1.20 mg kg−1 미만의 C-5HT 함량을 보인 반면,
아라비카 커피의 90%는 1.40 mg kg−1을 초과하는 값을 보였다.
⇒ arachic-5HT 신호의 피크 면적을 참조하여 다양한 C-5HT 신호의 피크 면적비를 비교하면,
아라비카와 로부스타 커피 간의 또 다른 차이점을 관찰할 수 있다.
⇒ 로부스타 샘플에서는 arachic acid-5HT와 behenic acid-5HT의 양이 유사하여 피크 면적비가 1이다;
이와 대조적으로
⇒ 아라비카 커피에서는 arachic acid-5HT의 양이 2배 더 높아서 두 신호의 비율이 2배에 달한다.
- ┌ 폴리싱(polishing),
├ 왁스제거(dewaxing),
├ 스티밍(steaming), 또는
└ 카페인 제거(decaffeinating)와 같은
기술적 처리를 통해 커피 콩들의 왁스층을 제거하면 소화가 더 잘 되는 커피 브루가 추출된다 [125,129,131].
⇒ 따라서 1933년, 커피 원두가 특정 커피 애호가들에게 미치는 자극 효과를 최소화하기 위해
최초의 스티밍 방법이 개발되었다 [132].
⇒ 시간이 지남에 따라 이 방법은 반복적으로 개선되었다 [133–135]. - C-5HT가 커피 왁스의 주요 성분이지만,
이것이 처리되지 않은 커피의 바람직하지 않은 효과의 유일한 원인일 가능성은 낮다.
⇒ 이러한 가정의 한 가지 이유는 C-5HT의 낮은 수용성(2.3 mg l−1)이며,
⇒ 또 다른 이유는 처치 받지 않은 콩들로 만든 퍼콜레이드된 커피 브루에는 존재하지 않기 때문이다 [130]. - Fehlau & Netter [136]는
⇒ 쥐의 위 점막에 대한 커피 액(coffee infusions)의 영향을 연구하면서 비슷한 결론을 내렸다. - 커피 원두를 증기 처치(steaming)하면
⇒ 왁스층의 부분적 제거를 낳고, 따라서 C-5HT도 부분적으로 제거된다.[137] - 未-處置 콩들과 處置된 콩들의 total C-5HT 함량을 비교했을 때, C-5HT 손실량은 30%에 해당한다.
그러나 증기 처치가 다양한 C-5HT에 미치는 영향은 명백하다.
⇒ Hydroxy fatty C-5HT의 감소율은 약 40%인 반면,
불포화(unsaturated) C-5HT는 약 20%의 비율로만 감소했다.
⇒ 프로세싱 파라미터(시간, 온도)를 변경해도 30% 이상의 추가 감소는 발생하지 않는다.
⇒ 즉, 파라미터와 관계없이 트립트아미드(tryptamides) 총량의 약 30%가 항상 동일하게 감소한다. - 커피의 C-5HT 함량은 매우 다양하기 때문에,
샘플의 C-5HT 총량만을 보고 "처치됨(treated)" 또는 "미처리됨(untreated)"이라고 단정 지을 수는 없다.
⇒ Kahweol과 cafestol의 유리 함량과 같은 다른 파라미터들도 고려해야 한다. - 커피의 또 다른 중요한 가공 방법은 디카페인 프로세싱이다.
⇒ 다양한 디카페인 방법들의 효과를 분석되었고, 그 결과가 ➡ Figure 20.42에 기록되어 있다.
⇒ 한 CO2 method (A)은 약 20%의 감소를 가져오는 반면,
다른 CO2 method (B)은 총 C-5HT 함량을 60% 감소시킨다.
⇒ 디클로로메탄(dichloromethane)과 에틸 아세테이트(ethyl acetate)를 사용하여
디카페인 공정을 수행했을 때, 총 C-5HT 함량에 가장 큰 영향을 미치는 것으로 나타났다.
최대 85%의 감소가 관찰되었다.

- 또한, C-5HT는 로스팅 과정에서 부분적으로 분해된다 [125,138].
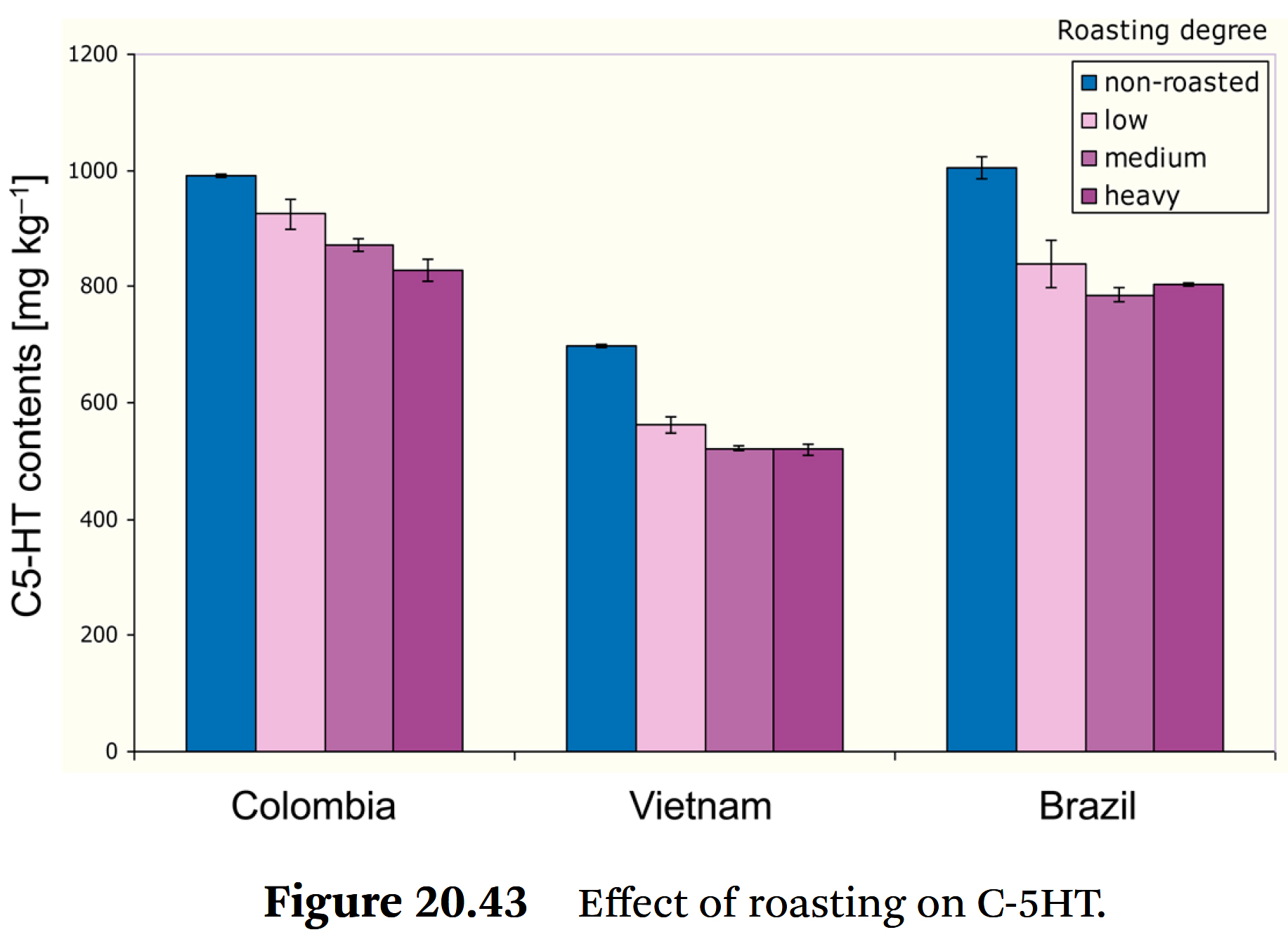
- Figure 20.43은
➡ 약배전, 중배전, 강배전으로 로스팅한 두 종류의 아라비카 커피와
한 종류의 로부스타 커피의 결과를 보여준다.
⇒ C-5HT 함량의 감소는 커피 콩들을 찐 경우보다 뚜렷하지 않다.
⇒ 로스팅 정도에 따라 약배전에서는 7%, 중배전에서는 12%, 강배전 컬럼비아에서는 약 17%의 분해가 발생한다.
⇒ 로스팅 프로세스는 원두를 찐 것과 유사하기 때문에
hydroxy fatty acids를 가진 C-5HT 그룹에 가장 큰 영향을 미쳤다.
⇒ 약배전 조건에서도 이 그룹의 양은 약 20% 감소하며,
다른 그룹과 달리 로스팅 정도가 증가해도 이 수준을 유지한다.
- Viani and Horman [139]은
⇒ carboxylic acid-5HT의 열분해 경로를 제안했지만,
⇒ 추정된 성분 중 일부만 Zahm et al. [140]에 의해 확인되었다 (Figure 20.44). - 이들을 상용 표준 화합물들 및 문헌의 질량 스펙트럼들과 비교했을 때,
주요 비휘발성 분해산물은
⇒ serotonin(세로토닌), 5-hydroxyindole (하이드록시인돌) (5HI),
3-methyl-5-hydroxyindole (5-hydroxyskatol, 5HS), 그리고
3-ethyl-5-hydroxyindole로 확인되었다.[141]
⇒ 熱 負荷 增加로 인해 로스팅 시간이 길어지면서 언급된 화합물의 추가 열분해가 발생했고,
동시에 octadecanamide(옥타데칸아미드), octadecanenitrile (옥타데칸니트릴), 그리고
octadecanoic acid(옥타데칸산)으로 확인된 다른 화합물의 생성도 증가했다.
⇒ 불포화 지방산과 장쇄 지방산(long chain fatty acids )(C21 및 C20:1)으로 구성된 C-5HT를 사용한
로스팅 실험에서 상응하는 분해 화합물들이 식별되었다 [141].

20.7.1 Pyrolysis/GC-MS Experiments
- 합성된 C-5HT가 열분해 스터디를 위해 사용된 바 있다 [141].
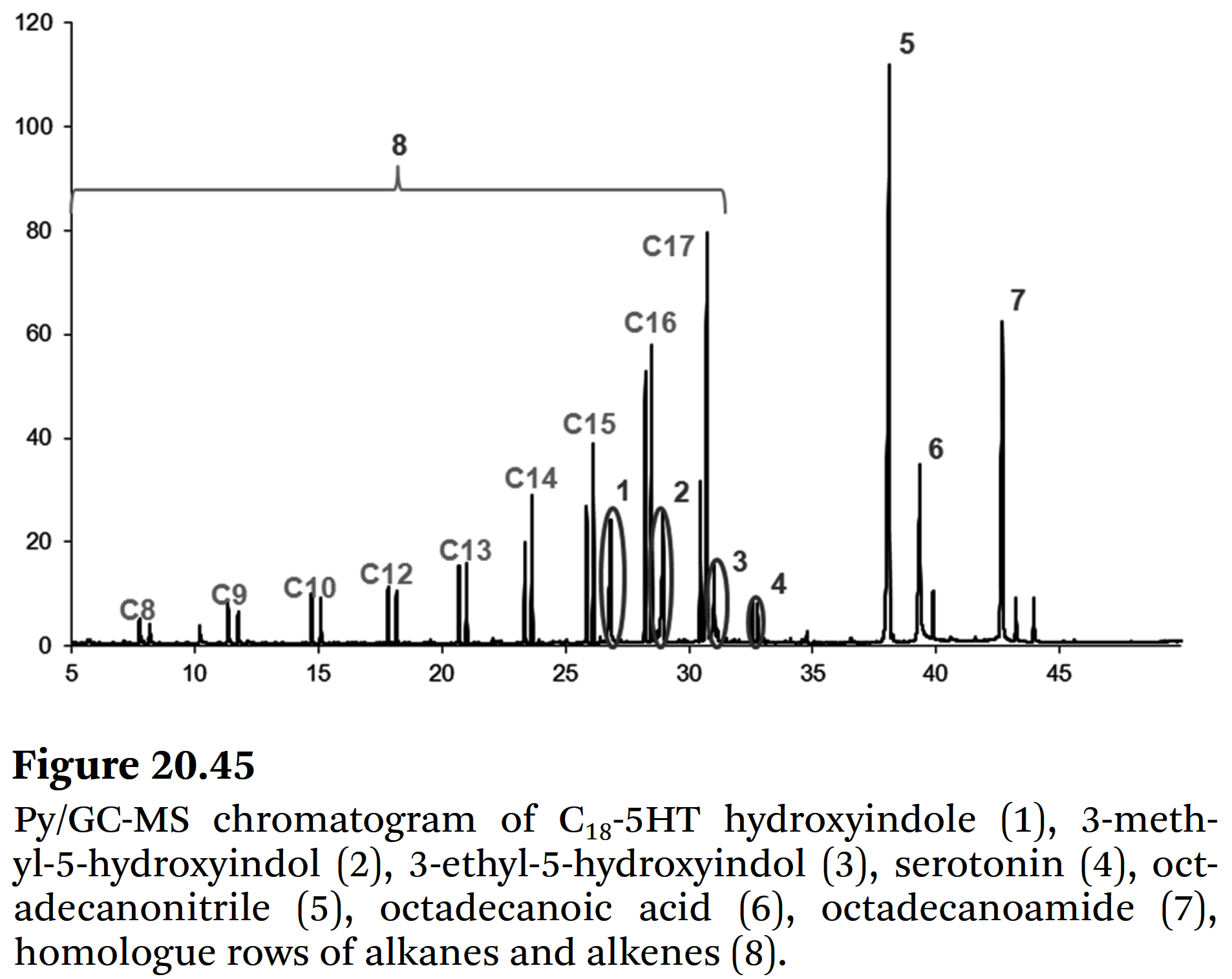
- Figure 20.45에서, C18-5HT의 Py/GC-MS chromatogram가
⇒ alkanes 및 alkenes (C6–C17) 그리고
⇒ 다음과 같은 이미 식별된 분해 산물들인
5-hydroxyindole (1),
3-methyl-5-hydroxyindole (2),
3-ethyl-5-hydroxyindole (3), and
serotonin (4)의 homologue rows를 보여준다.
⇒ 또한, 추가적으로
octadecanonitrile (5),
octadecanoic acid (6), and
octadecanoamide (7)도 검출되었다.
⇒ 머찬가지로, 그에 상응하는 분해 산물들이 of C20:1-5HT의 열분해에 의해 분석되었다.
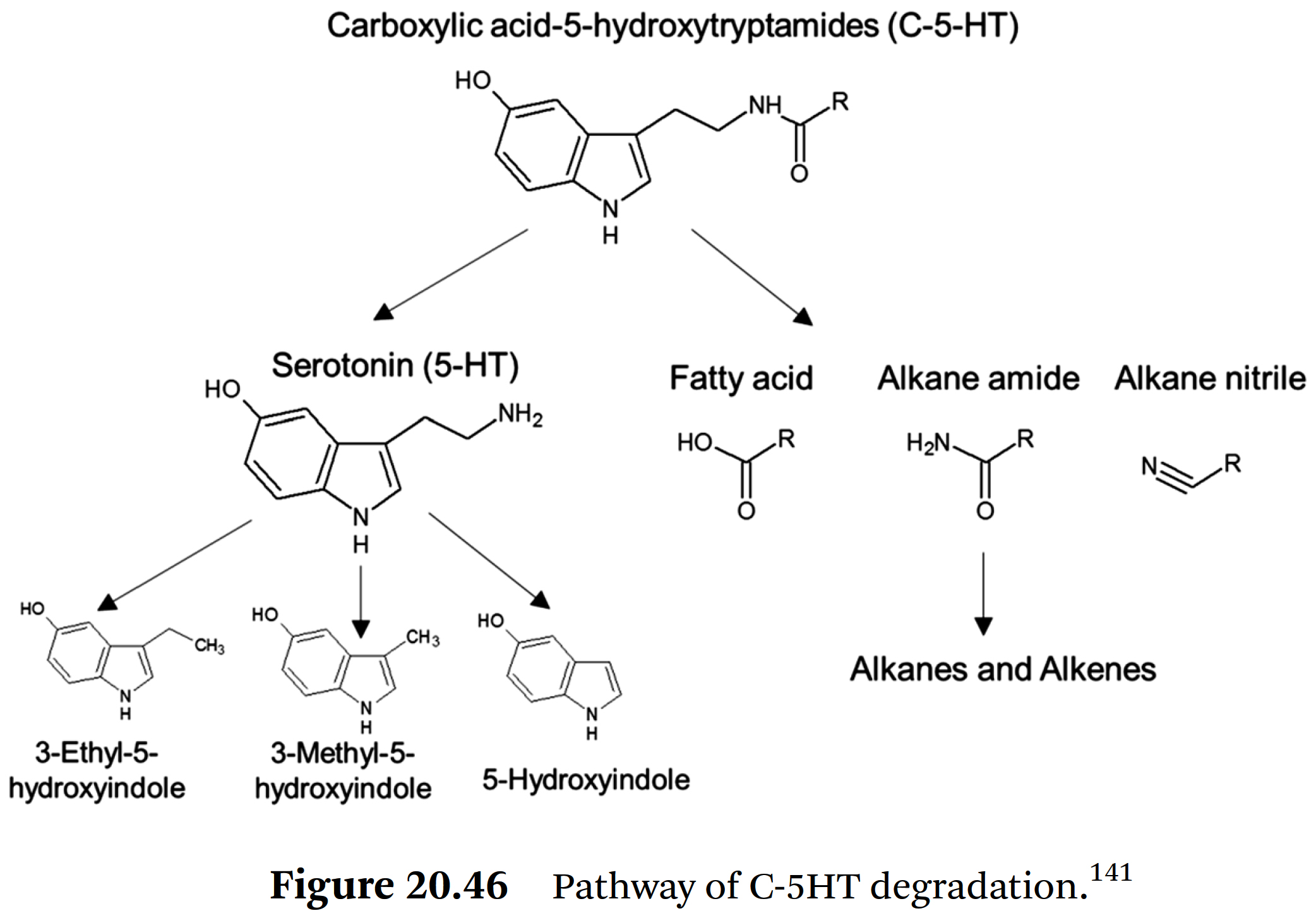
- 로스팅 실험 결과와 관련하여, C-5HT의 가장 가능성 있는 분해 경로가 Figure 20.46에 제시되어 있다.
- C-5HT는
⇒ 먼저 α-cleavage를 통해
⇒ serotonin(세로토닌), 5-hydroxyindole, 3-methyl-5-hydroxyindole, 3-ethyl-5-hydroxyindole,
그리고 이에 상응하는 지방산, fatty acid nitrile, fatty acid amide로 분해된다.
⇒ 열 부하가 증가하면
인돌 프레임(indol frame)이 열분해되어
⇒ 알칸(alkanes)과 알켄(alkenes)이 형성된다. - 그러나 Viani and Hormann [139]이 추정했던 것처럼
⇒ 인덴(indene)이나 인돌 프레임(indole-frame)을 갖는 화합물은 검출되지 않았다.
References











'Coffee Chemistry' 카테고리의 다른 글
| 커피빈의 蛋白質 (20) | 2025.08.01 |
|---|---|
| 커피의 窒素化合物 (12) | 2025.07.28 |
| 커피 멜라노이딘의 분석, 구조, 형성경로, 생리활성 및 건강영향 (16) | 2025.07.23 |
| 커피 멜라노이딘 : 구조, 형성, 건강 효능 (16) | 2025.07.20 |
| 커피의 화학 성분 (17) | 2025.07.17 |




댓글