
리서치 하이라이트
• 아라비카 특유의 쓴맛을 내는 모잠비오사이드는 커피 로스팅 과정에서 분해된다.
• 이전에는 알려지지 않았던 더 강한 쓴맛을 가진 열분해 산물들이 생성된다.
• 새로운 화합물들의 구조가 NMR과 HR-MS를 통해 규명되었다.
• 새로운 화합물들은 TAS2R43 및 TAS2R46(HEK 293T-Gα16gust44)에 대한 강력한 작용제이다.
• 분자 도킹 시뮬레이션이 쓴맛 수용체 내에서의 배열을 확인한다.
목차
| ■ Abstract | ||
| 1. Introduction | ||
| 2. Materials and methods | ||
| 2.1. Chemicals | ||
| 2.2. Coffee samples | ||
| 2.3. Synthesis of 17-O-β-D-glucosyl-11-oxocafestol-2-one (IS, 9) | ||
| 2.4. Quantitative analysis of mozambioside, its roasting products, and aglycone | ||
| 2.4.1. Stock solutions and working solutions | ||
| 2.4.2. Calibration curves | ||
| 2.4.3. Matrix-free model roasting of pure mozambioside | ||
| 2.4.4. Estimation of extraction time of analytes 1–8 from coffee powder | ||
| 2.4.5. Preparation of quality controls (QCs) | ||
| 2.4.6. Sample preparation of coffee powder | ||
| 2.4.7. Sample preparation of coffee brews | ||
| 2.4.8. Software and calculations | ||
| 2.4.9. Instrumentation | ||
| 2.5. Human study | ||
| 2.5.1.Determination of recognition and bitter taste thresholds | ||
| 2.5.2. Recombinant of mozambioside roasting products | ||
| 2.5.3. Genotyping of the human sensory panel for the absence of TAS2R43 | ||
| 2.6. Illustrations | ||
| 3. Results & discussion | ||
| 3.1. Method development | ||
| 3.2. Time- and temperature-dependent pyrolysis of mozambioside | ||
| 3.2.1. Degradation in model pyrolysis | ||
| 3.2.2. Analysis of coffee during roasting | ||
| 3.3. Mozambioside and roasting products in commercial coffee powders | ||
| 3.4. Concentrations of mozambioside and the major roasting products in different coffee brews |
||
| 3.5. Human sensory of mozambioside roasting products | ||
| 4. Conclusions | ||
| ■ Abbreviations |
||
| ■ Appendix A. Supplementary data | ||
| ■ References | ||

Abstract
- 커로스팅은 커피 화합물인 모잠비오사이드(1)를 여러 산물로 분해하는데, 여기에는
■ 17-O-β-D-glucosyl-11-hydroxycafestol-2-one (2),
■ 11-O-β-D-glucosyl-16-desoxycafestol-2-one (3),
■ 11-O-β-D-glucosyl-(S)-16-desoxy-17-oxocafestol-2-one (4),
■ 11-O-β-D-glucosyl-15,16-dehydrocafestol-2-one (5),
■ 11-O-β-D-glucosyl-(R)-16-desoxy-17-oxocafestol-2-one (6),
■ bengalensol (7), 그리고
■ 11-hydroxycafestol-2-one (8)이 포함된다. - UHPLC-MS/MS 분석법을 이용하여 1~8을 정량화하고,
실제 커피 로스팅 과정에서 생성되는 화합물의 양을 모니터링했다. - 커피 분말에서 1과 주요 로스팅 산물들인 4, 5, 7의 농도는 21.0~170.4 nmol/g 범위였으며, 약 41~128%가 브루로 추출되었다.
- 1, 2, 그리고 4~8의 인간 쓴맛 식역치가 측정되었다.
- 주요 로스팅 산물들은 1 (132 μM)보다 낮은 역치(27~80 μM)를 나타냈다.
- 패널들의 유전자형 분석 결과,
모잠비오사이드 파생물에 대한 민감도와 TAS2R43 유전자좌의 온전한 존재 사이에 상관관계가 있는 것으로 나타났다. - 커피 농도에서 1~8의 조합은 패널리스트의 80%에서 쓴맛을 인지하게 했으며, 이는 이 화합물 계열이 커피의 맛 프로필에 영향을 미치는 것을 시사한다.
1. Introduction
- 볶은 커피는 볶은 향(roasty odor)과 쓴맛(bitter taste)이 지배적인 자극 효과(stimulating effects)와 매력적인 센서리 프로파일(attractive sensory profile)로 높이 평가받고 있다 (Batali et al., 2022).
- 기본적인 맛 특질 중 하나인 쓴맛에 대한 구강 지각은 약 ~25개의 쓴맛 수용체(bitter taste receptors)인 TAS2Rs에 의해 매개되며, 이들은 G-단백질 결합 수용체(G-protein coupled receptors) 클래스 A이다 (Behrens, 2020).
- 카페인이 가장 잘 연구된 생리활성 화학물질 중 하나이며 커피에서 가장 널리 알려진 쓴맛 물질이다 (Nehlig, 2018).
카페인은 다섯 가지의 서로 다른 쓴맛 수용체들(TAS2R7, TAS2R10, TAS2R14, TAS2R43, TAS2R 46을 활성화하지만 (Meyerhof et al., 2010), 커피의 쓴맛에 기여하는 구체적인 역할은 아직 완전히 밝혀지지 않았다. - 생커피(생두, raw coffee)와 로스팅된 커피(roasted coffee)의 카페인 함량은 거의 동일하지만 (Muhammed et al., 2021), 로스팅된 커피는 쓴맛으로 인식되는 반면, 생두는 그렇지 않다.
- 카페인이 제거된(decaffeinated) 볶은 커피와 카페인이 들어있는 볶은 커피 두 가지 모두 쓴맛으로 인식되며 (Šeremet et al., 2022), 이는 로스팅이 쓴맛 형성의 주요 원인임을 강조한다.
- 로스팅 과정에서 생성되는 것으로 보고된 핵심 쓴맛 물질에는
■ 클로로겐산의 열 유도 락톤화 반응으로 생성되는 카페욜 퀴나이드(caffeoyl quinides)
(Farah et al., 2005; Frank et al., 2006; Frank et al., 2008),
■ 커피 단백질의 열분해로 생성되는 디케토피페라진(diketopiperazines)
(Ginz & Engelhardt, 2000; Ginz & Engelhardt, 2001), 그리고
■ 카페산 잔기에서 유래하는 4-비닐카테콜 올리고머(oligomers of 4-vinylcatechols)
(Frank et al., 2007; Guillot et al., 1996)가 있다. - 이러한 화합물들은 쓴맛을 유발하지만, 어떤 쓴맛 수용체가 이러한 쓴맛 지각을 매개하는지에 대해서는 아직 밝혀지지 않았다.
- 모잠비오사이드(1, 11-O-β-D-glucosyl-17-hydroxycafestol-2-one)는
➡ cafestol의 친수성 파생물(hydrophilic derivative)이며 (Richter & Spiteller, 1979),
➡ 카페인이 없는 Coffea 종에 특히 풍부하다 (Prewo et al., 1990). - 모잠비오사이드 (1)는
➡ 카페인보다 약 10배 더 쓴맛이 강하며,
➡ 인간의 쓴맛 역치는 60 ± 10 μM(Lang et al., 2015)으로 보고되었으며,
➡ 이는 쓴맛 수용체인 TAS2R43과 TAS2R46에 의해 매개된다 (Lang et al., 2020). - 아라비카 커피 생두에서의 농도는 약 0.4–1.2 μmol/g이다.
- 그러나 로스팅 과정에서 1은 최종 산물에서 맛 識閾 이하의 잔기들로 분해된다.
- 그러나, 1의 분해는 새로운 화합물들의 생성을 망라한다.
최근에,
■ 17-O-β-D-glucosyl-11-hydroxycafestol-2-one (2),
■ 11-O-β-D-glucosyl-16-desoxycafestol-2-one (3),
■ 11-O-β-D-glucosyl-(S)-16-desoxy-17-oxocafestol-2-one (4),
■ 11-O-β-D-glucosyl-15,16-dehydrocafestol-2-one (5),
■ 11-O-β-D-glucosyl-(R)-16-desoxy-17-oxocafestol-2-one (6), 그리고
■ bengalensol (7)이 로스팅 중에 형성되는 모잠비오사이드의 분해산물들로 식별되었다 (Czech et al., 2024). - 화합물 2, 4~6은
그들의 전구체 1과 같은 쓴맛 수용체 TAS2R43과 TAS2R46을 활성화하였지만,
4~6의 효능은 1에 비해 더 높았던 반면
2의 효능은 1에 비해 더 낮았다. - 분석물질 1, 2, 그리고 4~7이
진짜 커피 브루에서 UHPLC-ToF-MS에 의해 검출되었는데, 이는 커피 맛에 대한 가능한 공헌을 제시한다. - 우리는 HEK 293 T-Gα16gust44 세포를 과-발현하는 TAS2R43와 TAS2R46에서 더 높은 효능을 가지는 구조적으로 관계된 모잠비오사이드 분해산물들이 아라비카 커피로 마련된 커피 브루의 구강 지각된 쓴맛에 기여할 수도 있을 것이다는 가설을 설정한다.
- 그러므로, 본 연구의 목적은 다음과 같다
1) 커피 브루 내의 분석물질 1~8의 정확하고 정밀한 정량화를 위해
강력한 UHPLC-MS/MS method를 개발.
2) 커피 로스팅 중 분석물질 1-8의 형성과 변성을 정량화.
3) 커피 브루잉 동안 1-8의 추출 특성을 평가.
4) 인간 센서리 연구에서 모잠비오사이드 파생체 2와 4-8의 쓴맛 역치를 결정.
5) 아라비카 커피 브루의 구강 쓴맛 인지에 1-8이 공헌할 수 있는 가능성을 밝힘.
6) 모잠비오사이드 파생체에 민감한 두 수용체 중 하나인 TAS2R43이
유럽 인구의 인간 유전체에서 자주 결실되므로, 이 유전자 결실이 모잠비오사이드에서 유래한
커피의 쓴맛 화합물들의 지각에 영향을 미친다고 가설을 세운다.
2. Materials and methods
2.1. Chemicals
- 센서리 분석을 위한 화학물질들과 순수 에탄올(≥99 %)은 Merck KGaA (Taufkirchen, Germany)로부터 구입.
- NMR을 위한 중수소화 메탄올(Deuterated methanol)은 Euriso-Top (Giv sur Ivette, France)로부터 구입,
LC용 솔벤트들은 JT Baker (Deventer, The Netherlands)로부터 구입. - 물(초순수)은 Advantage A 10 System (Millipore, Molsheim, France)으로부터 준비.
- ■ Mozambioside (1),
■ 17-O-β-D-glucosyl-11- hydroxycafestol-2-one (2),
■ 11-O-β-D-glucosyl-16-desoxycafestol-2-one (3),
■ 11-O-β-D-glucosyl-(S)-16-desoxy-17-oxocafestol-2-one (4),
■ 11-O- β-D-glucosyl-15,16-dehydrocafestol-2-one (5),
■ 11-O-β-D-glucosyl-(R)-16-desoxy-17-oxocafestol-2-one (6),
■ bengalensol (7) and
■ 11-festol-2-one (8)는 우리의 선행 연구들로부터 이용 가능했음 (Czech et al., 2024). - 센서리 스터디용 생수(Evian®) 및 상업용 커피 파우더 블렌드들은 현지 상점들로부터 구입.
- Quantitative 1H NMR (qNMR)은 보고된 바와 같이
Bruker AV III system (Bruker, Rheinstetten, Germany) at 400 and 500 MHz에서 구했음. - 정밀 질량 데이터 (UPLC-Time-of-Flight MS)는 보고된 바와 같이
an ExionLC UHPLC system (Sciex, Darmstadt, Germany)를
6600 Triple ToF (Sciex, Darmstadt, Germany)와 연결하여 구해졌음 (Czech et al., 2024).




2.2. Coffee samples
- 콜롬비아産 Coffea arabica L. 커피는 Pacandé Kaffeerösterei KG (Munich, Germany)에서 공급받았다.
- 상업용 로스팅을 돌려 분취물들(Aliquots) (10 g per time point)은
0, 2, 5, 7, 9분 후에 샘플 채취되어 분석 때까지 보관되었다. - 추가적인 커피 샘플들 (콜롬비아産 아라비카 커피 샘플들)은 소매 구입하였다.
2.3. Synthesis of 17-O-β-D-glucosyl-11-oxocafestol-2-one (IS, 9)
- 원심분리관(centrifuge tube)(12ml)에, 분리된
17-O-β-D-glucosyl-11-hydroxycafestol-2-one (2, 10 mg, 19.7 μmol)을 아세톤(5ml)에 용해시켰다. - Dess-Martin periodinane (데스-마틴 피리오디난) (10mg, 23.6μmol)을 첨가한 후,
혼합물을 실온에서 교반하고 mass spectrometry로 측정하였다. - 산화가 완료되면, m/z 531([M+Na]+)의 반응물이 환원되고 m/z 529([M+Na]+)의 산물이 생성되었다.
이때 물(5ml)을 첨가하고 아세톤을 증발시켰다. - 원심분리(4000 rpm, 4℃, 20분) 후 얻은 상청액을
C18 컬럼 (Hyperclone, 250 ×10 mm, 5 μm, Phenomenex, Aschaffenburg, Germany)을 이용하여
semi-preparative HPLC로 분리하여, 기존에 보고된 조건(Czech et al., 2024)을 이용하여 목적 화합물을 정제했다. - 간단히 말해, 컬럼 용출액은 280 nm에서 관찰하였고; 피크들은 수동으로 수집하여 동결건조(20℃, 48시간, <2 mbar)를 통해 건조했다.
- 용리액(Eluents)은 밀리포어水에 0.1% 포름산(eluent A) 그리고 아세토니트릴(용리액 B)을 사용했으며; 유속은 분당 4.7ml였다.
- Binary gradient는 5% B로 시작하여 (등용매, 5분), 20분 이내에 30%로 증가시키고 (등용매, 4분), 3분 이내에 100%로 증가시킨 후 (등용매, 3분), 5분 이내에 5%로 감소시켰다 (등용매, 5분).
- 동결건조 후, 17-O-β-D-glucosyl-11-oxocafestol-2-one (IS)을 백색 거품 형태로 얻었고,
NMR 분석을 위해 d3-ACN에 용해시켰으며,
농도는 정량적 1H NMR로 측정하였다 (Frank et al., 2014; cf. Supporting Figure 14). - 추가 NMR 데이터와 2D 스펙트럼은 Supplemental Information에 나와 있다 (cf. Supporting Figures 1–5).
17-O-β-D-glucosyl-11-oxocafestol-2-one (9, IS):
UHPLC-ToF-MS (ESI+): Rt. Time (9.80 min);
found m/z 529.2042 [M +Na]+, calculated for C26H33O10Na (Δ-0.4 ppm);
1H NMR (d3-ACN): 0.95 (s, 3H, H20), 1.60 (s, 2H, H15), 1.76 (1H, H6), 1.76 (1H, H7), 1.87 (1H, H7), 1.90 (1H, H12), 2.11 (1H, H6), 2.24 (1H, H9), 2.33 (1H,H13), 2.36 (1H, H12), 2.38 (1H, H14), 2.48 (2H, H1), 2.81 (d, 1H, H14), 2.85 (dd, J =12.4 Hz, 1H, H5), 3.11 (t, J =9.2, 1H, H2’), 3.21 (1H, H4’), 3.31 (t, J =9.0 Hz, 1H, H3’), 3.31 (t, J =9.0 Hz, 1H, H5’), 3.47 (d, J =9.5 Hz, 1H, H17), 3.60 (1H, H6’), 3.78 (d, J =9.5 Hz, 1H, H17), 3.78 (1H, H6’), 4.27 (d, J =8.2 Hz, 1H, H1’), 6.59 (d, J =1.6, 1H, H18), 7.73 (d, J =1.7, 1H, H19);
13C NMR (d3-ACN): 15.7 (CH3, C20), 22.1 (CH2, C6), 37.1 (CH2, C12), 37.9 (CH2, C7), 42.9 (C10), 43.8 (CH, C5), 44.3 (C8), 46.1 (CH2, C14), 46.1 (CH, C13), 52.8 (CH2, C15), 53.5 (CH2, C1), 62.1 (CH2, C6’), 68.0 (CH, C9), 70.7 (CH, C4’), 73.3 (CH2, C17), 73.7 (CH, C2’), 76.3 (CH, C3’), 76.6 (CH, C5’), 103.6 (CH, C1’), 110.2 (CH, C18), 141.1 (C4), 146.6 (C3), 148.4 (CH, C19), 184.4 (C2), 214.2 (C11).
2.4. Quantitative analysis of mozambioside, its roasting products, and aglycone
2.4.1.Stock solutions and working solutions
- 모잠비오사이드 (1), 그 로스팅 산물들 (2~7), 아글리콘 8, 그리고
내부 스탠다드 17-O-β-D-glucosyl-11-oxocafestol-2-one (9, IS)을 각각
d3-MeOD에 용해시키고, 각각
6.61ppm과 7.80ppm에서의 H18과 H19의 신호를 사용하여
정량적 1H NMR에 의해 농도를 측정하였다
(Czech et al., 2024; Frank et al., 2014; cf. Supporting Figures 6~14). - 1~8의 적절한 분취량들을 합하고
메탄올로 희석하여 화합물 당 1200nM의 분석물 작업 용액을 얻었다. - IS의 원액을 메탄올로 희석하여 최종 농도가 600nM이 되도록 하였다.
2.4.2. Calibration curves
- 분석물 작업 용액(1-8, 1200 nM)을 물로 1+1 단계로 연속 희석하여
600.0, 300.0, 150.0, 75.0, 37.5, 18.8, 9.4, 4.7, 2.3, 1.2 nM 농도의 표준 용액을 제조했다. - 이 용액들을 100 μL씩 나누어 IS 작업 용액(600 nM, 100 μL)과 혼합했다.
- 스탠다드들은 반복하여 분석하였고,
피크 면적비(peak area ratios) 對 분석물 및 내부 표준물질의 농도비(concentration ratios)를
그래프로 표시하고,
1/x의 가중치를 적용한 선형 회귀 분석을 통해 검량선을 작성했다.
2.4.3. Matrix-free model roasting of pure mozambioside
- 순수 모잠비오사이드(1.7mg, 13.8μmol)를 메탄올(10ml)에 용해시켰다.
- 100μl씩 4세트의 오토샘플러 바이알(각 10개)에 피펫으로 나누어 넣고, 용매를 공기 흐름으로 제거했다.
- 바이알을 200, 220, 240, 260℃로 설정된 히팅 블록에서 0, 1, 2, 3, 4, 5, 6, 7, 9, 11분 동안 열에 노출시켰다.
- 각 노출 시간 후, 물(1ml)을 첨가하여 열 노출을 즉시 종료했다.
- 50μl씩 IS(600nM, 50μl)와 혼합하여 UHPLC-MS/MS로 분석했다.
2.4.4. Estimation of extraction time of analytes 1~8 from coffee powder
- 커피 가루(1g)를 비이커에 넣고 갓 끓인 물(50ml)에 현탁한 후 96℃의 핫플레이트 위에서 교반했다.
- 5, 10, 15, 30, 60, 120, 180, 240, 300, 360분 후,
시료(n = 2, 100 μl)를 채취하여 원심분리(4500 rpm, 10분, 4℃)했다. - 맑은 상청액 20 μl를 IS(600 nM, 20 μl)와 혼합하여 UHPLC-MS/MS 시스템에 주입했다.
- 평균값들을 One-way ANOVA로 비교한 후, 다중 비교를 위해 Tukey’s correction을 수행했다.
2.4.5. Preparation of quality controls (QCs)
- 분석물이 없는 매트릭스(微結晶 셀룰로스, 1g)에 1~8을 첨가하여
low QC (1.2nmol/g)와 high QC (12nmol/g)를 얻었다. - 첨가된 물질들을 회전 증발기에서 건조하고, 동결건조(20℃, 48시간, <2mbar)한 후 균질화했다.
- 첨가된 물질의 분취량(100mg)을 계량 플라스크(5ml)에 넣었다.
- 뜨거운 물(~96℃, 4ml)을 첨가하고 현탁액을 배양했다.
- 플라스크를 표시선까지 채우고 혼합한 후 원심분리했다(4500 rpm, 10분, 4℃).
- 분취량 (50μl)을 IS (600nM, 50μl)와 혼합하여 UHPLC-MS/MS 시스템에 주입했다.
- 정확도 Accuracy (Acc, %)는 측정된 농도와 명목 농도(nominal concentration)의 백분율 비율로 계산했다.
- 정밀도 Precision은 반복 실험들의 상대 표준 편차 relative standard deviation (RSD, %)(n=7)로 계산했다.
- 반복성 Repeatability는 단일 샘플(m = 6)의 반복 주입에 대한 상대 표준 편차(RSD, %)로 계산했다.
2.4.6. Sample preparation of coffee powder
- 커피 분말(1g)을 50ml 계량 플라스크에 넣고 칭량했다.
- 뜨거운 물(~40ml, ~96℃)을 넣고 현탁액을 혼합하여 배양했다.
- 앨리컷을 원심분리(4500 rpm, 10분, 4℃)하고,
필요한 경우 aqueous CAN (물에서 5%)으로 1+9 (v+v)로 희석했다. - 앨리컷들(50μl)을 IS (50μl, 600nM)와 혼합하여 UHPLC-MS/MS 시스템에 주입했다.
- 라이트 로스팅과 다크 로스팅 커피의 반복 시료(각각 n=7)를 분석하여,
실제 시료의 日中(하루내) 정밀도(intra-day precision)를 평가했다. - Intra-day precision을 평가하기 위해 시료를 2일(m=3)에 걸쳐 3회씩 준비하여 분석했다.
2.4.7. Sample preparation of coffee brews
- 라이트 로스팅 커피(Caffè Crema)와 다크 로스팅 커피(Espresso)를 사용했다
(100% 아라비카 콜롬비아, cf. Supporting Table 6). - 커피 브루들(필터 커피, 터키식 추출액, 프렌치 프레스, 콜드 브루)은
커피 분말과 물의 일정한 비율(5.4g/100ml, w/v; 아래 참조)로 준비했다. - 에스프레소 추출액은 모카 포트(11g/50ml, w/v; 아래 참조)로 마련했다.
- 채취한 각 시료를 원심분리(7000rpm, 15분)하고,
맑은 상청액을 물/ACN(95/5, v/v)으로 1 + 99(v + v)로 희석했다. - 분취량(20μl)을 IS(20μl)와 혼합하여 UHPLC-MS/MS 시스템에 주입했다.
2.4.7. Sample preparation of coffee brews
- 필터 커피 브루.
유리 깔때기에 넣은 종이 필터에 커피 가루(5.4g)를 넣고 뜨거운 증류수(~95°C)를 계량 플라스크(100ml)에 스며들게 했다. 4분간 배양한 후, 분석을 위해 분취량을 채취했다. - 터키식 커피 브루.
커피 가루(5.4g)를 비이커에 계량하여 넣고 뜨거운 밀리포어(Millipore) 물(~96°C, 100ml)에 현탁한 후 끓였다.
현탁액을 주걱으로 저어준 후 4분간 방치하고 혼합했다. 분석을 위해 분취량을 채취했다. - 프렌치 프레스 브루.
커피 가루(5.4g)를 카라페(carafe)에 계량하여 넣고, 뜨거운 밀리포어 물(~96°C, 100ml)에 현탁했다.
4분간 방치한 후 플런저를 누르고 상청액에서 분취량을 채취했다. - 콜드브루.
비이커에 커피 가루(5.4g)를 차가운 밀리포어(Millipore) 물(6°C, 100ml)에 현탁했다.
혼합물을 파라필름(Parafilm®)으로 덮고 냉장고(6.8°C)에서 17시간 동안 둔 다음 여과했다. 분석을 위해 분취량을 채취했다. - 에스프레소 브루.
에스프레소 추출은 제조사의 지침에 따라 퍼콜레이터(Bialetti®)를 사용하여 에스프레소 커피 가루(약 11g)와 뜨거운 물(약 96°C, 100ml)을 사용하여 추출했다.
최종 추출량은 50ml였는데, 하단 용기의 모든 내용물이 상단 용기로 옮겨지지 않았기 때문이다. 분석을 위해 샘플을 채취했다.
2.4.8. Software and calculations
- 데이터는 Analyst 1.6.3 (Sciex, Darmstadt, Germany)을 사용하여 수집했다.
- 적분, 캘리브레이션 곡선 작성, 정밀도 및 정확도 계산은 Multiquant 3.0.3 (Sciex, Darmstadt, Germany)을 사용하여 수행했다.
- 이후 계산은 Microsoft Excel 2016에서 수행했다.
- Windows용 GraphPad Prism 버전 10.2.2(GraphPad Software, Boston, Massachusetts, USA, www.graphpad)를 사용하여 one-way ANOVA 후 Tukey’s multiple comparison test를 수행했다.
- 이상치들는 Graphpad (ROUT method, q = 5%)에서 식별했다.
- OriginPro 2021b (OriginLab Corporation, Northampton, MA, USA)를 사용하여 캘리브레이션 곡선을 그리고 시각화했으며, linear fit function으로 모델을 조정했다.





2.4.9. Instrumentation
- UHPLC-MS/MS 시스템은
ExionLC UHPLC 시스템 (Sciex, Darmstadt, Germany)과
QTrap 6500 MS/MS 시스템 (Sciex, Darmstadt, Germany)을 연결하여 구성되었으며,
positive electrospray (ESI+) 모드로 작동하며 다음과 같은 이온 소스 매개변수들을 사용했다:
이온 분사 전압: 5500V, 소스 온도: 300℃, 분무 가스: 55 psi, 히터 가스: 50 psi, 커튼 가스: 45 psi. - Collision cell entrance potential (CEP), declustering potential (DP), collision energy (CE), cell exit potential (CXP)를 포함한 MS/MS 매개변수들은 각 화합물과 질량 전이에 따라 조정되었으며, Supporting Table 2에 요약되어 있다.
- 각 화합물의 dwell time은 10ms였고, total cycle time은 0.75초였다.
- 크로마토그래피 분리는 C18 컬럼 (Kinetex C18, 100×2.1mm, 1.7μm, Phenomenex, Aschaffenburg, Germany)에서 수행했다.
- Eluent A는 1% 포름산 수용액을 사용했고, eluent B는 1% 포름산 아세토니트릴액을 사용했다.
- 주입 후, B를 5%(0.5분)로 유지한 후, 1분 동안 15%, 2분 동안 20%로 증가시켰으며, 유속은 400μl/min였다.
유속을 500μl/min으로 증가시키고 7분간 유지했다 (20% B, isocratic).
유속을 400μl/min으로 감소시키고, B를 100%(0.5분)로 증가시킨 후, 1분 동안 유지한 후, 5%(0.5분, 등용매 2분)로 낮추었다. - 총 분석 시간은 17분이었다.
- 컬럼 용출액은 0.5분에서 17분 사이에 waste로부터 MS/MS 시스템으로 유입되었다.

2.5. Human study
- 모잠비오사이드 (1)와 그 TAS2R-활성적 로스팅 산물 2, 4~7, 그리고 아글리콘 8의 센서리 특성 분석은
사람에 의한 센서리 스터디에서 수행되었다. - 그 스터디에는 뮌헨 공과대학교 라이프니츠 식품 시스템 생물학 연구소에서 모집된
11명의 자원자(n =11, 여성 7명, 남성 4명, 연령: 33±8세)가 포함되었다. - 패널리스트들은 센서리 특성 분석 및 맛 식역 측정에 정기적으로 참여했으며, 알려진 미각 장애 병력은 없었다.
- 본 연구 프로토콜은 뮌헨 공과대학교 윤리위원회(votes 2023–19-NM-KH 및 2023–19_1- NM-BA)의 평가 및 승인을 받았다.
- 본 연구는 the Declaration of Helsinki에 따라 수행되었으며, 모든 참가자는 서면 동의를 제공했다.
2.5.1. Determination of recognition and bitter taste thresholds
- 인간 인지 및 쓴맛 식역 농도는 DIN 10955:2024–01에 따라
3-Alternative Forced Choice (3-AFC) test를 통해 측정했다. - 분석물질은 에탄올(≥99.8%, 200 μl)에 용해하고, 분석물질 1, 2, 4~8의 1+1(v+v) 희석액을 생수(Evian®, 10 ml)에 준비했다.
- 空시료에는 동일한 에탄올 농도를 사용했다.
- 데이터 분석 및 역치 계산은 ISO 13301:2018(E) 및 ASTM E679–19 표준에 따라 수행되었으며,
best-estimate thresholds (BET)를 계산하는 간단한 방법을 사용했다. - 마지막 생략된 농도(the last omitted concentration)의 제곱근과 처음으로 정답을 맞힌 시료를 각 개체의 BET 값으로 사용했다.
- 각 집단의 BET는 모든 개별 BET 값의 기하 평균으로 나타낸다.
- 효율적이고 신뢰할 수 있는 센서리 평가를 위해 'Stop 3' 중단 규칙을 적용했다 (p =1/27; Peng et al., 2012).
- Recognition thresholds (재인 식역)은
쓴맛이 아닌 감각을 포함하여 ' different oral impressions’을 기반으로 정확하게 식별된 샘플로 정의했다. - Bitter thresholds (쓴맛 식역)은 '쓴맛'에만 기반하여 정확하게 식별된 샘플들로 정의했다.
- 참가자들은 센서리 스터디 2시간 전부터 커피 섭취를 중단했다.
- 코 클립을 사용하여 喉鼻腔 知覺(Retronasal perception)을 피했다.
- 참가자들은 가장 낮은 농도로 시작했으며, 센서리 평가 후 시험 샘플을 뱉아 내도록 권장되었다.
- 각 농도 단계마다 입을 물로 헹구었다.
2.5.2. Recombinant of mozambioside roasting products
- 모잠비오사이드 (1), 로스팅 산물들 2~7, 그리고 아글리콘 8의 적절한 농도를
커피 브루(다크 로스트, 필터 방식, Table 3 및 Supporting Table 12 참조)에서 발견되는 농도와 일치하도록 재조합했다. - 농도는 다음과 같았다: 1: 2.1 μM; 2: 1.0 μM; 4: 3.2 μM; 5: 2.2 μM; 6: 0.8 μM; 7: 2.1 μM; 8: 0.4 μM.
2.5.3. Genotyping of the human sensory panel for the absence of TAS2R43
- 센서리 패널의 유전자형 분석(genotyping)을 위해, 제조사의 지침에 따라
ORAGENE-DNA 수집 튜브(OG-500, Steinbrenner Laborsysteme GmbH, Wiesenbach, Germany)를
사용하여 개인별 타액 샘플을 수집했다. - 이전에 발표된 바와 같이, 게놈 DNA를 분리하고 PCR을 통해 유전자형을 분석했다 (Roudnitzky et al., 2016).
- 간략하게 설명하면, 수집된 타액(500 μl)에서 prepITL2P 시약(DNA-Genotek)을 사용하여 게놈 DNA를 분리하고, 원심분리 후 에탄올로 침전시키고, 증류수에 용해했다.
- Advantage Taq 2 Polymerase Mix (Takara Bio Europe SAS, Saint-Germain-en-Laye, France)를 사용한 PCR 증폭의 경우, 분리된 게놈 DNA(각 100 ng)를 템플릿으로 사용했다.
- 다음과 같은 oligonucleotides (Eurofins Genomics Germany GmbH, Ebersberg, Germany)를 사용한 Multiplex-PCR이 이전과 같이 수행되었다
(사이클링 매개변수: 1× 1분 95℃, 35× 30초 95℃, 1분 68℃, 1× 1분 68℃, 유지 온도 4℃): - 43A_for, 5’-AGCAACAGACAAGTTACTATTCAAAAGAAGC-3′;
43A_rev, 5’-CCAATGTCAAACAGGAAAGCATCTCAAT-3′;
43B_for, 5’-TCACGGATAGGGATTAAATGGTGGAAT-3′;
43B_rev, 5’-ACAATGCTTCTGGCCCATTTTCTCT-3′.
2.6. Illustrations
- 목차 그래픽(table of contents graphic, TOC)은 Biorender.com을 사용하여 제작되었다.

3. Results & discussion
- 커피 로스팅 과정에서, 생커피에 존재하는 원래 성분들은 열에 의해 분해되고(thermally degrade), 이러한 전구체들로부터 새로운 화합물들이 생성된다.
- 쓴맛을 내는 디테르펜 배당체(diterpene glycoside)인 mozambioside (1)는 이 과정에서 맛 식역 이하의 잔류물들로 상당히 분해된다 (Lang et al., 2015).
- 동시에, 모잠비오사이드(1)는, 동일한 인간 쓴맛 수용체인 TAS2R43과 TAS2R46을 더 높은 효능으로 활성화하는 구조적으로 관련된 파생체들 (Fig. 1)를 생성한다 (Czech et al., 2024; Lang et al., 2020).
- 모잠비오사이드 로스팅 산물들이 로스팅된 커피의 쓴맛에 미치는 영향을 평가하기 위해서는, 정량적 분석 및 센서리 데이터가 필요하다.
- 따라서 커피에서 모잠비오사이드(1), 분해 산물들(2~7), 그리고 아글리콘(8)을 정량화하기 위한
targeted UHPLC-MS/MS 분석법이 개발되었다.

3.1. Method development
- 모잠비오사이드의 파생물을 합성하여 UHPLC-MS/MS에서 분석물의 신호 정규화(normalization)를 위한
internal standard (IS)로 사용하였다. - 분리된 분석물 2의 C11을 Dess-Martin periodinane으로 산화시키고, 반분취 HPLC로 정제하여
17-O-β-Dglucosyl-11-oxocafestol-2-one (9)을 얻었다. - 그 생성물은 뚜렷한 나트륨화된 유사분자 이온(m/z 529.2042 ([M + Na]+)을 나타냈으며,
이는 계산된 합 화학식 C26H34O10과 잘 일치하였다. - NMR 분석 결과 (cf. Supporting Figures 1–5), 푸란 부분(furane moiety)과 글루코실 치환기(glucosyl substitute)는 변하지 않은 반면, the secondary hydroxyl C11 (δ 64.8)은 carbonyl (δ 214.2)로 산화되었음을 확인하였다.
- 분석물질 1~8과 internal standard 9의 개별 스톡 용액들을 제조하고,
정량적 1H NMR 스펙트로스코피로 농도를 측정했다 (cf. Supporting Table 1). - 1과 3~9는 ESI+ 모드에서 MS/MS 시스템에 지속적으로 주입(constant infusion)하고,
전구체 이온 [M + H]+와 collision-induced dissociation (CID)(충돌-유도적 해리)로
생성된 단편들을 소프트웨어-지원 최적화를 통해 개별적으로 최적화했다. - 분석물질 당 3개의 단편들을 quantifiers 및 qualifiers로 기록했다 (Supporting Figure 15).
- 일반적으로 지배적인 단편은 [M-hexose-H2O + H]+였다 (Table 1).
- 반면, 2는 주로 나트륨 이온 종들 [M + Na]+를 형성했으며, 이는 효율적으로 단편화되지 않았다.
- In-source fragment m/z 347 [M-Glc + H]+는
적절한 산물 이온들(suitable product ions)을 생성했으며, 전구체 이온으로 선택되었다 (cf. Supporting Table 2). - 화합물 1-3, 7, 8 그리고 등압 파생물들(isobaric derivatives) 4~6의 만족스러운 분리는
총 17분의 실행 시간 내에 달성되었다 (Fig. 2 참조).

- 분석물질 1~8의 혼합물(mixture)을 1.2~600 nM으로 연속 희석하고,
the internal standard 9와 혼합하여 캘리브레이션 곡선을 작성했다. - 반복 분석으로부터 수집한 분석물질/내부표준물질의 면적비를 각 농도비에 대해 그래프로 표시하여
선형 회귀 모델을 수립했다 (Supporting Figure 16). - Pearson’s r을 사용하여 面積比와 濃度比 간의 상관관계를 평가했다.
- Adjusted R-Square 값들은 화합물 1과 3~8의 경우 0.99로 강력한 상관관계를 나타냈고,
화합물 2의 경우 0.98이었다 (Table 1). - 보정된 농도 범위(calibrated concentration range)는
80~120% 정확도와 ≤15% 정밀도의 역계산 농도를 갖는 표준물질들에 의해 정의했다. - 순수 표준 용액(neat standard solution)에서,
signal/noise ≥3으로 정의되는 Limit of Detection (LoD)는 1~5 nM였다 (Table 1). - 2번 화합물의 민감도(sensitivity)는
다른 글루코실화 분석물질들(glucosylated analytes)에 비해 낮았다. - 화합물 7은 효율적으로 단편화 되지 않아 LoD가 비교적 높았다.

- 우리의 최근 연구(Lang et al., 2015)와 유사하게, 샘플 준비는 가능한 한 직선적이었으며, 커피 시료를 뜨거운 물에 현탁하는 과정을 포함했다.
- 분석물질의 정량적 추출에 필요한 최소 시간을 추정하기 위한 실험에서,
레귤러 로스팅 커피(Caffé Crema)와 다크 로스팅 커피(Espresso)를 약 96 ℃에서 교반하고,
5~360 분 후에 분취량을 분석했다. - 300분 이상 배양한 결과, 상청액에서 1~8의 유의미한 농도 변화(P > 0.05)는 없었으므로,
정량적 추출에 충분한 것으로 판단되었다 (Supporting Figures 17 and 18, Supporting Table 7). - 따라서 시료를 96 ℃에서 300분 동안 처리한 후, 원심분리하여 정제하고,
물로 희석한 후, 내부 표준물질과 혼합하여 UHPLC-MS/MS 시스템에 주입했다. - 실제 커피 샘플을 사용하여
Intra-day precision (일중 정밀도) 및 inter-day precision (일간 정밀도)를 평가했다. - 일반 커피(Caffè Crema)와 다크 로스트 커피(에스프레소)를 3일 동안 반복 분석했다
(n = 3 × 3, cf. Supporting Tables 5 and 6). - 모든 분석물질들에 있어서,
Caffè Crema의 Intra-day precision은 3.6~11.5%였으며, 반복성은 3.1~7.4%였다. - Inter-day precision는 1.4~11.2%였다.
- 다크 로스트 커피의 매트릭스는 까다로워서 더욱 다양한 결과를 보였다.
- Intra-day precision은 9.3~25.5%였으며, 반복성은 1.8~8.3%였다.
- Inter-day precision은 0.9~14.0%였다.
- 추가 실험에서, 분석물질이 없는 매트릭스로
微結晶 셀룰로스를 1.2 nmol/g 및 12.0 nmol/g 농도로 첨가하여 recovery를 평가했다. - Recoveries는 81.6~100.7%였으며, precision은 1.2~11.7%였다 (cf. Supporting Table 4).
- 이 방법은 모델 로스팅, 커피 로스팅, 그리고 커피 블렌드에서
모잠비오사이드(1), 그 로스팅 산물들 2~7, 그리고 아글리콘 8에 대한 정량적 데이터를 수집하는데 적용되었다.
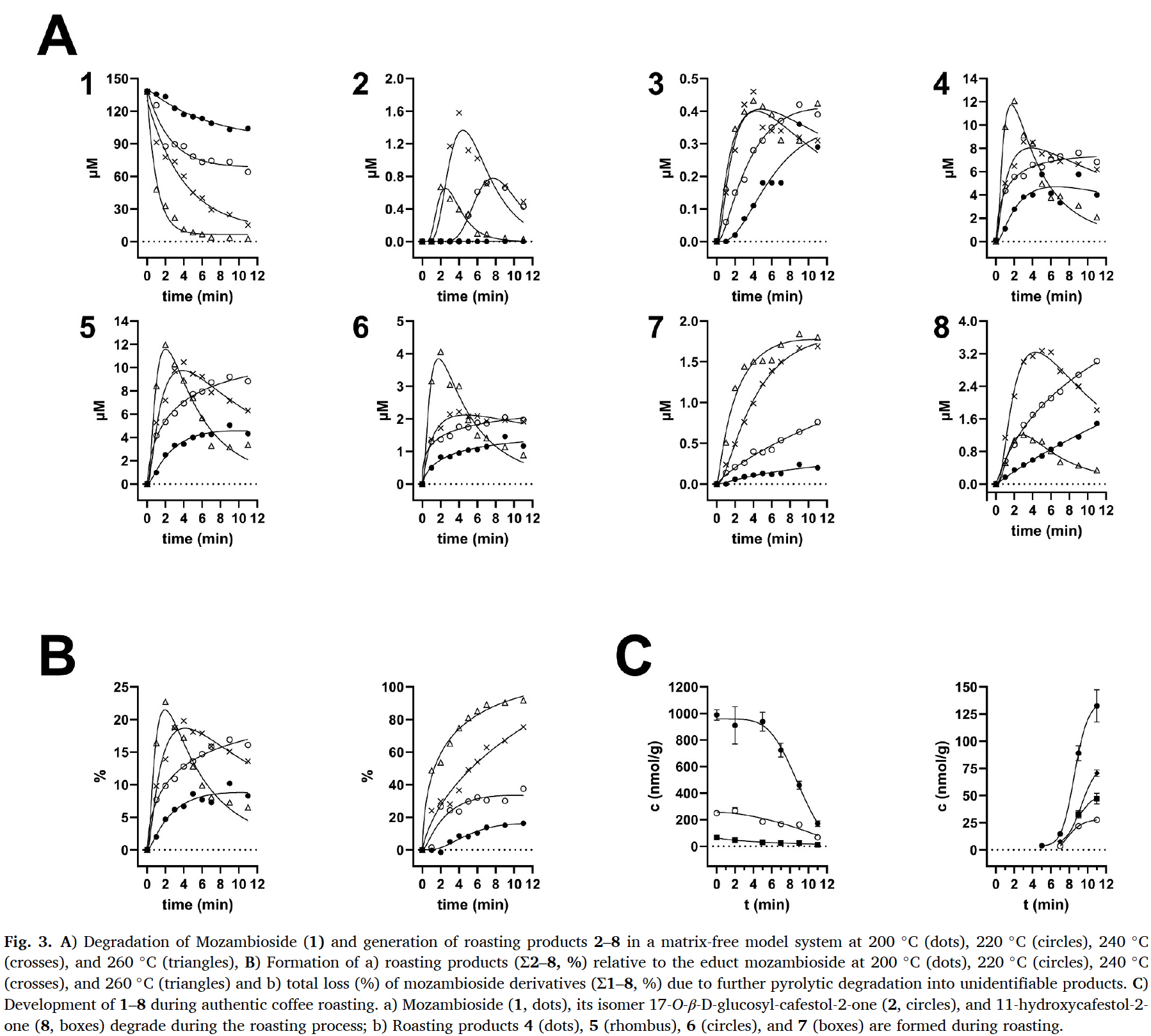
3.2. Time- and temperature-dependent pyrolysis of mozambioside
3.2.1. Degradation in model pyrolysis
- 순수 모잠비오사이드(1)를 200, 220, 240, 260℃에서 1~11분 동안 가열하였다.
- 1의 상대적 잔류량과 알려진 로스팅 산물 2~7 (Czech et al., 2024) 및 아글리콘 8의 생성량을 정량화하여,
matrix-free pyrolysis에서 생성 및 분해 과정을 자세히 조사하였다 (Fig. 3A). - 1은 로스팅 조건들 하에서 분해되었다.
- 200℃에서는 11분 후 약 15% 감소한 반면, 260℃에서는 7분 이내에 정량적인 분해가 나타났다(Fig. 3A, 1).
- Isomer 2 (Fig. 3A, 2)는 ≥220℃에서 형성되었지만, 일반적으로 형성 정도는 낮았으며,
220℃ (8분, 0.72 μM), 240℃(4분, 1.58 μM), 260℃(2분, 0.75 μM)에서 최대값을 보였다. - 3은 최대 농도가 0.46 μM(240℃, 4분)으로 미량만 형성되었다.
- 4와 5는 각각 260℃에서 ~12 μM에 도달했다 (Fig. 3A, 4 and 5).
- 6은 2분 후(~4 μM) 260℃에서 최대 형성에 근접했다.
- Bengalensol (7)은 200℃와 220℃에서 거의 선형적인 형성을 보였다.
240°C와 260°C에서 11분 후, 최대 농도는 약 1.7 μM에 근접했다 (Fig. 3 A, 7). - 8은 모잠비오사이드의 로스팅 과정에서도 유리되어
240°C에서 4분에서 6분 사이에 넓은 최대값을 보인 후, 추가 열 노출 시 분해되었다 (Fig. 3 A, 8).
260°C에서도 유사한 패턴이 관찰되었지만, 수율은 상당히 낮았는데, 이는 미지의 화합물로의 열분해 때문일 수 있다. - 분석물질 2, 3, 8은 각각 240℃에서 농도 최대값을 보인 반면,
분석물질 4~7은 260℃에서 더 높은 농도를 나타냈다. - 그러나 260℃에서 로스팅 산물 2~7 그리고 8은 분해되기 시작하여,
새로운 미확인 산물들을 형성했을 가능성이 있다. - 관찰된 이러한 농도 패턴은 로스팅 온도 조절이 매트릭스 없는 로스팅 모델에서 특정 분석물질의 생성 수율에 선택적으로 영향을 미칠 수 있음을 보여준다.
- 전반적으로 4~6이 주요 로스팅 산물이었다 (Fig. 3A).
- Fig. 3B, a는 전구체 모잠비오사이드(1) 대비 로스팅 산물 2-8의 수율(%)을 보여준다.
- 로스팅 전 초기 함량 대비 educt 1과 analytes 2-8의 합은
모잠비오사이드의 손실을 미확인 분해산물의 형성으로 추정했다 (Fig. 3B, b). - 모잠비오사이드(1)는 열에 노출되면 빠르게 분해되었다.
- 200℃에서 11분 후 1의 약 75%가 그대로 유지되었고, 약 10%가 분석물 2~8로 전환되었으며 약 16%가 미확인 생성물로 손실되었다.
- 220℃에서 1의 46%가 최종 시료에 남아 있었고, 약 16%가 분석물 2~8로 전환되었으며 38%가 손실되었다.
- 240℃에서 1의 76%가 손실되었고, 11%는 여전히 존재했으며, 13%는 분석물 2~8로 전환되었다.
- 마지막으로, 260℃에서 11분 후 거의 모든 모잠비오사이드가 분해되어 약 2%만 그대로 남았고, 약 7%는 2~8로 전환되었으며, 92%는 손실되었다 (cf. Fig. 3B a,b, Supporting Table 8).
- 모잠비오사이드를 단시간 고온(260℃, 2분)에 노출시켰을 때, 로스팅 생성물들의 형성은 최대 ~23%였다.
- 온도가 낮을수록 가열 노출 시간이 길어져 그 프로세스에 대한 컨트롤이 더 잘 이루어졌다.
- 그러나 추정 최대 전환율(모잠비오사이드가 로스팅 화합물로 전환)은 10~16%였다.
3.2.2. Analysis of coffee during roasting
- 모잠비오사이드(1,989.8±39.6nmol/g)의 가장 높은 함량은 생두 샘플(로스팅 시간 0분)에서 발견되었다.
- Isomer 2는 상당한 양(249.4±10.9nmol/g)으로 존재하여 약 25%를 차지했다.
- 아글리콘 8은 소량(65.8±7.9nmol/g)으로 존재하여 약 6.7%를 차지했다. 1:2:8의 비율은 약 75:19:5였다.
- 따라서 11-hydroxycafestol-2-one (8)의 약 94.7%가 열 노출 전에 글루코사이드 1과 2로 결합되었다.
- 모잠비오사이드, 그것의 isomer 2, 그리고 아글리콘 8이 로스팅 전 생두에 존재한다는 관찰 결과는 두 번째 생두 샘플에서도 확인되었다.
- 파푸아뉴기니의 이 샘플에서, 1은 1, 2, 8의 합의 ≥90%를 차지하는 반면,
콜롬비아의 생커피의 경우 ≥75%를 차지했다 (cf. Supporting Table 10). - 커피 로스팅 중 1, 2, 8의 분해와 3~7의 생성을 실제 진짜 샘플에서 모니터링했다.
- 샘플(콜롬비아 아라비카)은 상용 드럼 로스팅 프로세스에서 0, 2, 5, 7, 9, 11분 후에 수집하여 위에 자세히 설명된 대로 반복 분석했다.
- 로스팅 프로세스는 처음에 로스팅 드럼을 5분 동안 가열하는 것으로 시작되었다.
- 로스팅은 200~240℃의 온도에서 시작하여 녹색에서 베이지색으로, 마지막으로 갈색으로 변했다.
- 로스팅은 11분 동안 진행되었으며, 원두가 갈라지는 소리가 들리는 것으로 마무리되었다.
- 수집된 데이터는 Fig. 3C에 나와 있다 (cf. in Supporting Table 9의 One-way ANOVA을 적용한 표 데이터 참조).
- Fig. 3C는 로스팅 되지 않은 생두에서 검출된 1, 2, 8의 분해를 보여준다.
- 1의 농도는 처음 5분 동안 유의미한 변화가 없었다 (P > 0.05).
- 현저한 분해는 프로세스 개시 5분 후에 시작되었다.
- 로스팅 11분 후, 최종 로스팅 된 커피에는 초기 존재했던 모잠비오사이드의 17.2 ± 2.1%가 남았고, 이는 170.4 ± 20.6 nmol/g에 해당한다.
- Isomer 2는 로스팅 2분 후 초기 249.4 ± 10.9 nmol/g에서 269.1 ± 21.3 nmol/g로 농도가 증가했지만, 그 차이는 유의미하지 않았다.
- 로스팅 11분 후에는 로스팅 산물 3의 미량만 검출되었다.
- 분석물질 4~7의 생성은 로스팅 공정 1분 ≥5분 시점의 분해 시작과 동시에 발생했으며, 11분 후 최대 농도에 도달했다 (Fig. 3C, b).
- 전반적으로 4는 로스팅 산물 중 정량적으로 우세했으며, 농도가 크게 증가하여 11분 후 132.5±14.8nmol/g에 도달했다.
- Isomer 6은 유사한 생성 키네틱을 보였지만 수율은 상당히 낮아 최종적으로 27.6±0.8nmol/g에 도달했다.
- 4의 생성은 6보다 더 많았다 (4:6 비율은 약 ~80:20이었다).
- 로스팅 산물 5는 최종 존재비에서 두 번째로 높았으며, 11분 후 70.7±3.1nmol/g에 도달했다.
- 마지막으로, 벵갈렌솔(7)은 로스팅 공정 후반에 생성되어 11분 후 47.2±5.0nmol/g에 도달했다.
- 특히, 생성된 로스팅 생성물 4~7의 형성 곡선은 로스팅 프로세스가 11분 후 종료되었을 때 각각의 전환점과 최대 농도에 근접했다.
- 분석 물질 4, 5, 7이 최종 커피의 주요 로스팅 생성물이었다.
3.3.Mozambioside and roasting products in commercial coffee powders
- 다양한 상업용 커피(아라비카, 콜롬비아)를 분석하여 더 폭넓은 통찰력을 얻었다.
- 실제 상업용 커피 분말 내의 1~8번에 관한 데이터는 Table 2에 정리되어 있다.
- 놀랍게도, 1은 다크 에스프레소 로스트보다 라이트 로스트 커피 샘플에서 더 높은 농도를 보였으며, 이는 위에서 논의한 로스팅 프로세스 (3.2절)에서 관찰된 경향과 일치한다.
- 개별 농도들에서의 차이에도 불구하고, 분석 물질들의 비율은 다양한 커피 샘플에서 비교적 일정하게 유지되었다.
- 이러한 일관성은 커피 생산 과정에서 이러한 화합물의 형성에 예측 가능한 패턴이 있음을 나타낸다.
- 1:2:3:4:5:6:7:8의 평균 비율은 22:14:1:26:16:6:14:2였으며 (cf. Supporting Table 11), 이는 커피에서 이러한 분석 물질들의 일반적인 분포에 대한 기준점을 제공했다.
- 1, 4, 5가 우세한 화합물이었다.
- 샘플 전체에서 일관된 비율들은 비선택적인 형성 과정을 시사했다.


3.4. Concentrations of mozambioside and
the major roasting products in different coffee brews
- 우리는 커피 브루잉 동안의 추출 행태을 조사하여
1번과 그 로스팅 산물 2~8이 커피의 쓴맛에 미치는 영향을 평가했다. - 필터 커피, 터키식 커피, 프렌치 프레스, 콜드브루는 각각
동일한 Caffè Crema (라이트 로스트 커피)와 Espresso coffee (다크 로스트 커피) 샘플을 사용하여 마련되었으며,
분말-對-물의 비율은 일정하게 유지하여 두 샘플을 비교했다. - Espresso 음료는 특정 기기(Bialetti®)를 사용하여 라이트 로스트 커피와 다크 로스트 커피로 만들었다.
- 추출 수율에 대한 대략적인 추정치가 제시되어 있다 (Table 3).
- 두 타입 모두로 만든 커피 브루 내에서 관찰된 농도는 약간만 달랐다.
- 모잠비오사이드(1)는 브루잉 동안에 커피 분말로부터 71% 이상의 추출률로 효과적으로 추출되었으며(라이트 로스팅 커피를 사용한 에스프레소 추출 제외), 추출 방법 간에 유의미한 차이는 관찰되지 않아 이전 데이터(Lang et al., 2015)를 확인했다.
- 분석물질 3(데이터 없음)은 미량으로만 검출되었고, 분석물질 2와 벵갈렌솔(7)은 라이트 로스트 커피로 만든 브루들에서는 없었으며, 다크 로스트 커피로 만든 몇몇 브루들에서만 검출되었다.
- 이는 벵갈렌솔이 더 거친 로스팅 파라미터들 하에서 최고 농도에 도달한다는 연구 결과들을 뒷받침한다.
- 스탠다드 온수 브루잉 방법들의 경우에,
1번과 로스팅 산물들 4~6이 추출되었으며, 추출률은 63%에서 121% 사이였다. - 콜드 브루와 에스프레소 음료에서 가장 낮은 추출률들이 나타났으며, 이러한 분석물질들의 추출률은 42%에서 101% 사이였다.
- 이는 모카팟를 사용한 빠른 추출 프로세스 그리고 콜드 브루 추출 시 낮은 물 온도에 기인한다.
- 놀랍게도, 17시간의 배양 시간은 상당한 양의 분석물질 1, 5, 6, 8을 추출하기에 충분했으며, 뜨거운 물로 추출한 음료와 비슷한 농도에 도달했다.
- 분석 물질 6과 8(필터, 터키쉬)의 농도는
약배전 커피로 만든 브루에서 계산된 최대 농도를 초과하여 추출률이 121%에서 128%에 달했다. - 이 이론적인 추출률은 3회 반복 분석(n = 3)을 기반으로 커피 분말 내 각 분석 물질의 평균 농도를 기반으로 계산되었다.
- 그러나 그 브루에서 발견된 농도가 매우 낮았기 때문에 데이터 분석에서 사소한 편차라도 계산된 추출률에 상당한 영향을 미칠 수 있다.
- 결론적으로,
모잠비오사이드(1)와 로스팅 산물 4, 5, 7은 2.0~9.1 μM의 농도 범위에서 검출되었다. - 분석 물질 3은 미량으로 존재했고,
분석 물질 2는 7과 같이 다크 로스팅 커피로 만든 몇몇 브루에서만 검출되었다. - 그러나 로스팅 산물 6은 3.0μM에 도달했고,
로스팅 산물 8은 최대 농도 1.0μM에서 검출되었다. - 전반적으로, 정량화된 분석물들의 경우에 거의 완전한 추출이 추정되었다.

3.5. Human sensory of mozambioside roasting products
- 모잠비오사이드와 그 로스팅 산물들은 쓴맛 수용체인 TAS2R43과 TAS2R46을 표적으로 한다 (Czech et al., 2024; Lang et al., 2020).
- TAS2R43은 유럽 인구의 약 20%에서 결손되는 것으로 알려져 있으므로 (Roudnitzky et al., 2016),
쓴맛 식역치의 변동성이 클 것으로 예상했다. - 따라서 1~8에 대한 개별적 쓴맛 및 전반적 쓴맛 지각에 대한 논의를 위해
TAS2R43 유전형을 기준으로 감각 패널을 분석했다. - 인간의 TAS2R45 및 TAS2R43 유전자와 관련된 복제수 다형성(copy number polymorphisms)의 존재는
잘 알려져 있다 (cf. Fig. 4; Pronin et al., 2007; Roudnitzky et al., 2011, Roudnitzky et al., 2016). - 선행 연구에서는 인간의 12번 염색체에서 자주 결실되는
유전체 영역의 5’ 및 3’ limits를 향하는 프라이머(primers)를 사용하여
TAS2R43 유전자의 유전자 결실(gene deletions)을 분석하는 전략을 고안했다 (Roudnitzky et al., 2016). - 유전체 결실(genomic deletion)이 없는 경우,
이러한 프라이머는 앰플리콘(amplicons) PCR 43A 및 PCR43B를 생성하는 반면,
유전자 결실(gene deletion)의 경우
앰플리콘 43A의 정방향 프라이머(forward primer)와 앰플리콘 43B의 역방향 프라이머(reverse primer)에 의한 증폭(amplification)으로 짧은 앰플리콘(short amplicon) PCR 43C가 생성된다. - 따라서 TAS2R43 유전자의
두 개의 온전한 대립유전자가 존재하는지(=앰플리콘 43A와 43B가 보임, 앰플리콘 43C는 없음), 또는
대립유전자 중 하나가 결실되었는지(=앰플리콘 43A, 43B, 43C가 보임), 또는 두
대립유전자가 모두 결실되었는지(=앰플리콘 43C만 보임)를 평가할 수 있다. - PCR 샘플의 아가로스 겔 전기영동 패턴에서 알 수 있듯이,
두 명의 피험자는
TAS2R43 유전자 결실(피험자 1과 9, 그림 4B)과
온전한 TAS2R43 유전자(피험자 4와 5)에 대해 각각 동형(homozygous)인 것으로 확인되었지만,
대부분의 피험자는 이형적(heterozygous)이었다 (피험자 2, 3, 6, 7, 8, 10, 11, Fig. 4B). - 이러한 관찰 결과는 이전 관찰 결과와 잘 일치하며,
유럽 인구의 약 20%가 삭제된 TAS2R43 대립유전자에 대해 동형적(homozygous)임을 보여준다
(Roudnitzky et al., 2016). - 모잠비오사이드 로스팅 산물의 수율과 분리 가능량은 특성 분석되는 화합물들을 1, 2, 4~8로 제한했으며, 센서리 패널의 사이즈는 n =11로 제한했다.
- 참가자 수는 제한적이었고, TAS2R43 유전자의 두 가지 온전한 대립유전자를 가진 개인들(+/+, n =2)과 동형 결실 대립유전자를 가진 개인들(Δ/Δ, n =2)의 소규모 그룹으로 구성되었다.
- 따라서 우리는 센서리 경향만 보고할 수 있다.
- 쓴맛 식역치는 3-대안 강제 선택(3-AFC) 방식을 통해 결정되었다.
- 이 방식에서는 로스팅 산물의 농도를 증가시키면서 블라인드 방식으로 2개의 blanks와 함께 패널에게 제시되었다.
- 패널은
그 blanks와 차이를 불분명한 차이(인식 식역)와
뚜렷하게 느껴지는 쓴맛(쓴맛 식역)으로 구분하도록 요청 받았다. - 최근 발표된 수용체 식역(cf. Table 4, Czech et al., 2024)를 바탕으로, 화합물 1과 5~8의 쓴맛 식역은 주로 TAS2R43 활성화에 의한 더 민감한 반응에 의해, 그리고 화합물 2와 4는 TAS2R46에 의해 매개되는 더 민감한 반응에 의해 결정될 것으로 예상했다.
- 센서리 데이터는 Table 4에 정리되어 있다.
- 이 결과는 유전적 변이와 센서리 지각 사이의 복잡한 관계를 강조하며, 맛을 조절하는 근본적인 메커니즘에 대한 귀중한 통찰력을 제공한다.
- 모잠비오사이드(1)의 전반적 인간 쓴맛 역치는 132 μM으로, 발표된 데이터(Lang et al., 2015)와 유사했다.
- 화합물 2와 4는 유전자형 간에 유의미한 다른 경향을 보이지 않았다.
이는 화합물 2와 4가 주로 TAS2R46(Czech et al., 2024)을 촉발하기 때문에 예상된 결과였으며,
이 유전자에 대해서는 결실 현상이 보고되지 않았다. - 대신, 조기 종결 코돈(a premature stop codon)을 갖는 훨씬 덜 빈번한 수용체 유전자 변이가 보고되었다 (Roudnitzky et al., 2011).
- 4의 쓴맛 역치(27 μM)는 2(495 μM)보다 약 20배, 1(132 μM)보다 5배 낮았다.
- 화합물 5~8은 주로 TAS2R43을 촉발한다.
- 5번 화합물의 센서리 데이터는
2개의 온전한 대립유전자를 가진 개인(11 μM)이
이형 및 동형 결실 대립유전자를 가진 개인(각각 42 μM 및 52 μM)에 비해 더 낮은 역치를 나타냈다. - 6번 화합물에서도 유사한 경향을 관찰했는데,
두 개의 온전한 대립유전자를 가진 개인는 30 μM에서 쓴맛을 느꼈고,
두 개의 결실 대립유전자(Δ/Δ)를 가진 개체는 42 μM,
한 개의 결실 대립유전자(Δ/+)를 가진 개체는 52 μM에서 쓴맛을 느꼈다. - 두 개의 온전한 TAS2R43 유전자를 가진 패널리스트는
15 μM에서 벵갈렌솔(7)의 쓴맛을 감지했지만, 전체 패널 역치는 80 μM이었으며,
이는 TAS2R43 결실에 기반한 패널리스트의 예상 민감도와 잘 일치했다. - 화합물 8은 wild-type 패널리스트(11 μM)가 전체 패널(48 μM)에 비해
더 낮은 쓴맛 역치를 보이는 유사한 경향을 보였다. - Supporting Figure 19 참조.
- 우리는 dose-over-threshold values (DoT 값, 용량 대비 역치 값)을,
커피 브루의 농도(μM, Table 3)와
전체 센서리 패널의 쓴맛 역치(μM, Table 4, Supporting Table 12)를 곱한 값으로 계산하여,
커피의 쓴맛에 대한 추정 기여도를 추정했다. - DoT 값은
맛-활성적 화합물의 농도가 쓴맛 역치를 초과하여 미각에 영향을 미칠 수 있는지 여부를 공식적으로 나타낸다. - 1(0.02–0.05), 6(0.01–0.07), 7(0.03 및 0.08), 8(0.01–0.02)의 DoT 값들은 미미하여 커피 쓴맛에 영향을 미치지 않는 것으로 나타났으며, 4(0.11–0.34)와 5(0.07–0.17)는 그렇지 않은 것으로 나타났다.
- 이러한 결과는 모잠비오사이드나 그 로스팅 산물이 커피의 쓴맛에 직접적으로 영향을 미치지 않음을 시사한다.
- 그러나 1, 2, 4–8은 동일한 쓴맛 수용체를 표적으로 하기 때문에,
두 화합물이 역치 이하 농도로 혼합되었을 때 “sum effect"가 지각되는지 평가했다. - Triangle test에서, 재조합체(Supporting Table 13)를 센서리 패널에게 제시했다.
- 흥미롭게도, 참가자 11명 중 9명(α =0.01)이 혼합물을 정확하게 식별하여 "쓴맛" 및/또는 "다른 맛"으로 표현했는데,
이는 空시료와 유의미하게 다른 구강 느낌을 나타냄을 시사한다. - 쓴맛 식역 이하에서 유의미하게 농축된 분석물질들은 혼합물에서 눈에 띄는 쓴맛을 유발했다.
- 앞서 입증된 바와 같이,
이러한 분석물질들은 커피 음료에서 항상 함께 존재하며
재조합체에서의 농도에 비교할 만한 농도를 나타내므로 (Table 3 참조),
모잠비오사이드는 그 로스팅 산물들과 함께 커피의 쓴맛에 영향을 미치는 것으로 가정될 수 있다.
4. . Conclusions
- Mozambioside (모잠비오사이드)와 그 로스팅 산물들이
매트릭스가 없는 진짜 샘플에서 강력한 방법을 사용하여 정량 분석되었다. - 진짜 샘플들은 정확한 분석을 위해 신속하고 효율적인 정밀검사 프로세스(workup process)를 거쳤다.
- 모델 및 실제 로스팅 시리즈의 열분해 분석 결과,
분석물질 2, 3, 8의 농도는 240℃에서 최고치를 기록한 반면,
분석물질 4~7의 농도는 260℃에서 최고치를 기록했다. - 그러나 온도가 더 높으면 아직 알려지지 않은 구조로의 추가적인 분해가 발생할 수 있다.
- 실제 커피 로스팅에서 개별적 농도들에서의 차이들에도 불구하고 분석물질들의 비율은 일정하게 유지되었으며,
주요 분석물질인 분석물질 4, 5, 7은 로스팅 11분 후 최대 농도에 도달했다. - 아라비카 미디엄 로스트 커피 및 다크 로스트 커피에서 정량 분석 결과,
그 주요 로스팅 산물들인 분석물질 4와 5가 최대 100%까지의 브루로의 추출률을 보였다. - 인간 센서리 스터디에서 분석물질 5와 8의 쓴맛 역치가 11 μM으로 가장 낮았다.
- 모잠비오사이드와 비교했을 때, 주요 로스팅 산물인 4, 5, 6, 7은 쓴맛 역치가 약 1.5~5배 낮았다.
- 인간 센서리 스터디는 in vitro 쓴맛 수용체 식역 농도와 잘 일치했다.
- 그러나 훈련된 패널이 있었음에도 불구하고, 미각 민감도의 개인차가 관찰되었으며,
이는 패널 참여자의 유전자형을 반영한다. - 개별 모잠비오사이드 파생체들의 DoT factors는 < 1이어서 맛에 기여를 하지 않는 것으로 나타났지만,
진짜 식역하 농도들에서 재조합 혼합물은
두 개의 blanks에서 쓴맛/떫은맛(bitter/astringent)이 나는 것으로 인식되어
모잠비오사이드와 그 로스팅 산물들이 커피 음료의 쓴맛과 떫은맛에 영향을 미칠 수 있음을 시사했다.
Abbreviations
| UHPLC-MS/MS | Ultra high-performance liquid chromatography with tandem mass spectrometric detection |
| UHPLC-Time-of-Flight MS | Ultra high-performance liquid chromatography with Time-of-Flight mass spectrometric detection |
| NMR | Nuclear magnetic resonance spectroscopy |
| TAS2R | Bitter taste receptor type 2 |
Appendix A. Supplementary material
본 논문에 대한 Supplementary data (Supporting Information - Identification of mozambioside roasting products and their bitter taste receptor activation)는 온라인 상에서 다음 URL에서 볼 수 있다.
https://doi.org/10.1016/j.foodchem.2024.138884.
References
American Society for Testing and Materials. (2019). Standard practice for determination of odor and taste thresholds by a forced-choice ascending concentration series method of limits. West Conshohocken, PA: ASTM.
Batali, M. E., Lim, L. X., Liang, J., Yeager, S. E., Thompson, A. N., Han, J., … Guinard, J.- X. (2022).
Sensory analysis of full immersion coffee: Cold brew is more floral, and less bitter, sour, and rubbery than hot brew.
Foods, 11(16), 2440. https://doi.org/10.3390/foods11162440
Behrens, M. (2020). Bitter Taste.
In: Fritzsch, B. (Ed.) And Meyerhof, W. (volume editor), the senses: A comprehensive reference, vol. Vol. 3.
Elsevier, Academic Press, pp. 231–246. ISBN: 9780128054086.
Czech, C., Lang, T., Graßl, A., Steuer, A., Di Pizio, A., Behrens, M., & Lang, R. (2024).
Identification of mozambioside roasting products and their bitter taste receptor activation.
Food Chemistry, 44. https://doi.org/10.1016/j.foodchem.2024.138884
Deutsche Institut für Normung e.V. (DIN 10955:2024–-01, 2024). (2024).
Sensory analysis - testing of food contact materials and articles (FCM), Berlin.
Farah, A., De Paulis, T., Trugo, L. C., & Martin, P. R. (2005).
Effect of roasting on the formation of chlorogenic acid lactones in coffee.
Journal of Agricultural and Food Chemistry, 53, 1505–1513. https://doi.org/10.1021/jf048701t
Frank, O., Blumberg, S., Krümpel, G., & Hofmann, T. (2008).
Structure determination of 3-O-Caffeoyl-epi-γ-quinide, an orphan bitter lactone in roasted coffee.
Journal of Agricultural and Food Chemistry, 56, 9581–9585. https://doi.org/10.1021/jf802210a
Frank, O., Blumberg, S., Kunert, C., Zehentbauer, G., & Hofmann, T. (2007).
Structure determination and sensory analysis of bitter-tasting 4-Vinylcatechol oligomers and their identification in roasted coffee by means of LC-MS/MS.
Journal of Agricultural and Food Chemistry, 55, 1945–1954. https://doi.org/10.1021/jf0632280
Frank, O., Kreissl, J. K., Daschner, A., & Hofmann, A. (2014).
Accurate determination of reference materials and natural isolates by means of quantitative 1H NMR spectroscopy.
Journal of Agricultural and Food Chemistry, 62(12), 2506–2515. https://doi.org/10.1021/jf405529b
Frank, O., Zehentbauer, G., & Hofmann, T. (2006).
Bioresponse-guided decomposition of roast coffee beverage and identification of key bitter taste compounds.
European Food Research and Technology, 222, 492–508. https://doi.org/10.1007/s00217-005-0143-6
Ginz, M., & Engelhardt, U. H. (2000).
Identification of proline-based diketopiperazines in roasted coffee.
Journal of Agricultural and Food Chemistry, 48, 3528–3532. https://doi.org/10.1021/jf991256v
Ginz, M., & Engelhardt, U. H. (2001).
Identification of new diketopiperazines in roasted coffee.
European Food Research and Technology, 213, 8–11. https://doi.org/10.1007/s002170100322
Guillot, F. L., Malno¨e, A., & Stadler, R. H. (1996).
Antioxidant properties of novel tetraoxygenated phenylindan isomers formed
during thermal decomposition of caffeic acid.
Journal of Agricultural and Food Chemistry, 44, 2503–2510. https://doi.org/10.1021/jf9508155
International Organization for Standardization. (2024).
Technical Committee ISO/TC 34, Subcommittee SC 12 (ISO:13301–2018).
Sensory analysis-Methodology-General guidance for measuring odor, flavor, and taste detection thresholds by a three-alternative forced-choice (3-AFC) procedure. Food Products, Sensory analysis, 2nd edt.
Lang, R., Klade, S., Beusch, A., Dunkel, A., & Hofmann, T. (2015).
Mozambioside is an Arabica-specific bitter-tasting furokaurane glucoside in coffee beans.
Journal of Agricultural and Food Chemistry, 63(48), 10492–10499. https://doi.org/10.1021/acs. jafc.5b04847
Lang, T., Lang, R., Di Pizio, A., Mittermeier, V. K., Schlagbauer, V., Hofmann, T., & Behrens, M. (2020).
Numerous compounds orchestrate coffee’s bitterness.
Journal of Agricultural and Food Chemistry, 68(24), 6692–6700. https://doi.org/10.1021/acs.jafc.0c01373
Meyerhof, W., Batram, C., Kuhn, C., Brockhoff, A., Chuboda, E., Bufe, B., … Behrens, M. (2010).
The molecular receptive ranges of human TAS2R bitter taste receptors.
Chemical Senses, 35, 157–170. https://doi.org/10.1093/chemse/bjp09
Muhammed, B. L., Seid, M. H., & Habte, A. T. (2021).
Determination of caffeine and hydrogen peroxide antioxidant activity of raw and roasted coffee beans around Habru Woreda, Ethiopia using UV-vis spectroscopy.
Clin. Pharmacol., 13, 101–113. https://doi.org/10.2147/CPAA.S311032
Nehlig, A. (2018).
Interindividual differences in caffeine metabolism and factors driving caffeine consumption.
Pharmacological Reviews, 70, 384–411. https://doi.org/10.1124/pr.117.014407
Peng, M., Jaeger, S. R., & Hautus, M. J. (2012).
Determining odour detection thresholds: Incorporating a method-independent definition into the implementation of ASTM E679.
Food Quality and Preference, 25(2), 95–104. https://doi.org/10.1016/j.foodqual.2012.02.006
Prewo, R., Guggisberg, A., Lorenzi-Riatsch, A., Baumann, T. W., & Wettstein-Bättig, M. (1990).
Crystal structure of mozambioside, a diterpene glycoside of Coffea pseudozanguerbariae.
Phytochemistry, 3, 990–992. https://doi.org/10.1016/0031-9422(90)80065-O
Pronin, A. N., Xu, H., Tang, H., Zhang, L., Li, Q., & Li, X. (2007).
Specific alleles of bitter receptor genes influence human sensitivity to the bitterness of Aloin and saccharin.
Current Biology, 17, 1403–1408. https://doi.org/10.1016/j.cub.2007.07.046
Richter, H., & Spiteller, G. (1979).
Über ein neues Furokauranglycosid aus grünen Kaffeebohnen.
Chemische Berichte, 112, 1088–1092. https://doi.org/10.1002/cber.19791120403
Roudnitzky, N., Bufe, B., Thalmann, S., Kuhn, C., Gunn, H. C., Xing, C., … Wooding, S. P. (2011).
Genomic, genetic, and functional dissection of bitter taste responses to artificial sweeteners.
Hum. Mol. Gen., 20(17), 3437–3449. https://doi.org/10.1093/hmg/ddr252
Roudnitzky, N., Risso, D., Drayna, D., Behrens, M., Meyerhof, W., & Wooding, S. P. (2016).
Copy number variation in TAS2R bitter taste receptor genes: Structure, origin, and population genetics.
Chemical Senses, 41(8), 649–659. https://doi.org/10.1093/chemse/bjw067
Šeremet, D., Fabecic, P., Vojvodic Cebin, A., Mandura Jaric, A., Pudic, R., & Komes, D. (2022).
Antioxidant and sensory assessment of innovative coffee blends of reduced caffeine content.
Molecules, 27(2), 448. https://doi.org/10.3390/molecules27020448
'Coffee Chemistry' 카테고리의 다른 글
| 커피의 酸 (15) | 2025.07.09 |
|---|---|
| 人間 쓴맛 受容體의 生化學 (9) | 2025.06.04 |
| 커피 모잠비오사이드 로스팅産物들과 쓴맛 受容體 活性化 (6) | 2025.05.29 |
| 커피의 쓴맛 지각에 대한 유전적 소인의 역할 (29) | 2025.05.22 |
| 커피의 쓴맛을 증진하는 화합물들 (11) | 2025.05.22 |




댓글